题目内容
20.在NaClO和NaCl混合溶液中能大量共存的离子组是( )| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.H+、ClO-、Cl-发生氧化还原反应生成氯气,不能大量共存,故A错误;
B.Ag+、Cl-结合生成沉淀,不能大量共存,故B错误;
C.Fe2+、ClO-发生氧化还原反应,不能大量共存,故C错误;
D.溶液中该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
2.某单质跟浓硝酸反应时,每0.5mol单质反应就能将1mol硝酸还原为NO2,则单质被氧化后化合价为( )
| A. | +1价 | B. | +2价 | C. | +3价 | D. | +4价 |
11. 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
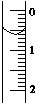
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1(列式计算);市售白醋总酸量=4.5g•100mL-1(列式计算).
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.100 0mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1(列式计算);市售白醋总酸量=4.5g•100mL-1(列式计算).
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
5.短周期元素X、Y、M、N的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10.X与M同主族,Y与N同主族,X、M原子的最外层电子数之和等于Y原子的次外层电子数.则下列叙述正确的是( )
| A. | 在Y、N的最高价氧化物中,Y、N与氧原子之间均为双键 | |
| B. | 一定条件下,Y单质能置换出N单质,M能置换出X单质 | |
| C. | N元素位于元素周期表中第3周期I V族 | |
| D. | 四种元素的原子半径:X<Y<M<N |
10.下列有关σ键和π键的说法错误的是( )
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
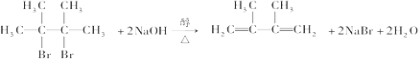 ;
;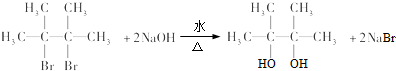 ;E与乙二醇的关系是同系物.
;E与乙二醇的关系是同系物. .
. ;
; 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.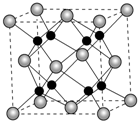 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: