题目内容
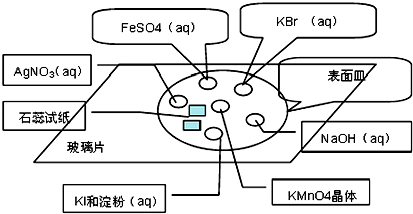
8.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液下列正确的操作顺序是( )| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
分析 除去粗盐中的Ca2+、Mg2+、SO42-,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子.
解答 解:要先除硫酸根离子,然后再除钙离子,碳酸钠可以除去过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤就行了,最后加盐酸除去过量的氢氧根离子碳酸根离子,顺序为:②⑤④①③.
故选C.
点评 本题主要考查了除杂质的原则,以及除杂质的顺序,这类题时常出现,要加以掌握,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.一定温度下,在三个体积均为2L的恒容密闭容器中发生反应:CO2(g)+H2S(g)?COS(g)+H2O(g).下列说法正确的是( )
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.1 | 0.15 | 0.05 | - |
| Ⅱ | 607 | 0.2 | 0.3 | - | |
| Ⅲ | 627 | 0.1 | 0.15 | - | 6×10-2 |
| A. | 该反应为吸热反应 | |
| B. | 607K时,该反应的平衡常数为0.50 | |
| C. | 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol.L-1 | |
| D. | 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动 |
19.用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
16.下列说法正确的是( )
| A. | 分子内共价键越强,分子越稳定,其熔沸点也越高 | |
| B. | C、H、O、N四种元素组成的化合物一定是离子化合物 | |
| C. | HF分子间存在着氢键,所以HF比HCl稳定 | |
| D. | 由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
3.下列说法中正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 伴有能量变化的变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
13.铷是一种碱金属元素,对于铷及其化合物性质的推断正确的是( )
①铷的熔点比钾的高
②氯化铷的水溶液 pH=7
③RbOH的碱性比NaOH强
④铷没有共价化合物
⑤铷不能从FeCl3溶液中置换出铁.
①铷的熔点比钾的高
②氯化铷的水溶液 pH=7
③RbOH的碱性比NaOH强
④铷没有共价化合物
⑤铷不能从FeCl3溶液中置换出铁.
| A. | ②③④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
18.能够证明溶液中一定大量存在CO32-的是( )
| A. | 加入硝酸银溶液时有白色沉淀产生 | |
| B. | 加入盐酸时有无色无味气体产生,该气体能使澄清石灰水变浑浊 | |
| C. | 加入氯化钙溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,且产生可使澄清石灰水变浑浊的无色无味气体 | |
| D. | 加入氢氧化钡溶液时有白色沉淀,再加稀盐酸反应现象如C |
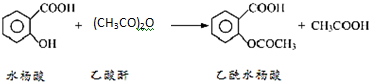
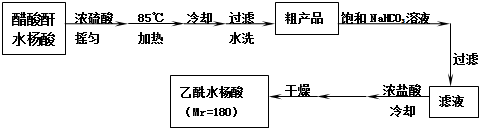
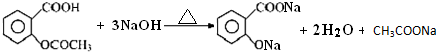
 阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(
阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(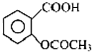 ).
).