题目内容
13.铷是一种碱金属元素,对于铷及其化合物性质的推断正确的是( )①铷的熔点比钾的高
②氯化铷的水溶液 pH=7
③RbOH的碱性比NaOH强
④铷没有共价化合物
⑤铷不能从FeCl3溶液中置换出铁.
| A. | ②③④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
分析 ①依据碱金属元素熔点从上到下依次递减规律判断;
②氯化铷为强碱强酸盐;
③依据碱金属元素最高价氧化物对应水化物碱性从上到下逐渐增强规律判断;
④铷性质活泼,极易失去电子,达到稳定结构;
⑤铷与盐溶液反应实质是先与水反应生成氢氧化铷,在发生复分解反应.
解答 解:①碱金属元素熔点从上到下依次递减,铷在钾的下方,所以熔点低于钾,故错误;
②氯化铷为强碱强酸盐,不水解,溶液呈中性,pH=7,故正确;
③碱金属元素最高价氧化物对应水化物碱性从上到下逐渐增强,铷在钠的下方,所以RbOH的碱性比NaOH强,故正确;
④铷性质活泼,极易失去电子,达到稳定结构,不会形成共价化合物,故正确;
⑤铷与盐溶液反应实质是先与水反应生成氢氧化铷,氢氧化铷与氯化铁反应生成氢氧化铁,得不到铁,故正确;
故选:C.
点评 本题考查了碱金属铷的性质,熟悉同主族元素性质的递变规律是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是( )
| A. | Cl2 | B. | KMnO4 | C. | HCl | D. | FeCl3 |
8.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液;⑤加过量的氯化钡溶液下列正确的操作顺序是( )
| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
18.下列离子方程式书写错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的电离方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2与H2O反应:Cl2+H2O═H++Cl-+HClO |
5.下列关于胶体的叙述中不正确的是( )
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
2.温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )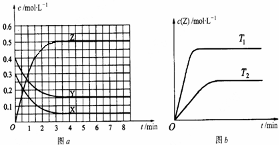

| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
3.从樟科植物枝叶提取的精油中含有成分之一的结构简式如图所示.若要检验其中的碳碳双键官能团,所用试剂正确的是( )

| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 溴的CCl4溶液 | D. | 银氨溶液 |
 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.