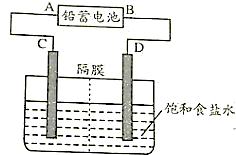
题目内容
17.氯气的制取按照传统的方法,一般采用浓盐酸与MnO2共热来制备氯气,但是这种方法制过程中存在缺陷.某学习小组采用新的方法来制备氯气并进行性质实验.Ⅰ.实验仪器及药品:
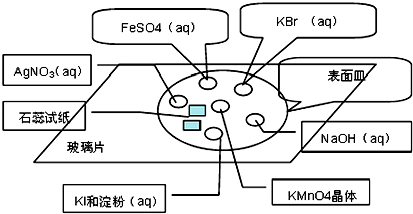
a.实验仪器:玻璃片、表面皿(顶部贴有湿润的蓝色石蕊试纸和干燥的石蕊试纸)、胶头滴管等
b.实验药品:KMnO4晶体、浓HCl、KBr溶液、淀粉溶液、KI溶液、FeSO4溶液、NaOH溶液、酚酞、KSCN溶液、AgNO3溶液、湿润的蓝色石蕊试纸和干燥的石蕊试纸.
Ⅱ.实验方法及图示:
①在玻璃片上分别滴加KBr溶液、FeSO4溶液、NaOH稀溶液、KI溶液、AgNO3溶液.
②在KI溶液中滴加一滴淀粉溶液
③FeSO4溶液中滴加一滴KSCN溶液
④NaOH稀溶液中滴加一滴酚酞溶液
⑤在以上溶液分布的中心放置一块KMnO4晶体,然后滴加2-3滴浓盐酸,迅速盖上表面皿.并观察实验现象.
(1)该反应实验原理:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
该反应中氧化剂与还原剂的物质的量之比为1:5;
(2)实验时反应一段时间后可以观察到KBr溶液由无色变为橙色,其离子反应方程式为Cl2+2Br-=2Cl-+Br2;
(3)滴有KSCN溶液的FeSO4溶液呈红色,其离子反应方程式为Cl2+2Fe2+=2Cl-+2Fe3+、Fe3++3SCN-=Fe(SCN)3;
(4)滴加淀粉溶液的KI溶液呈蓝色,湿润的蓝色石蕊试纸的变化为先变红后褪色,干燥的石蕊试纸的变化为无变化.
分析 (1)分析反应中元素化合价变化,判断氧化剂与还原剂,依据方程式判断氧化剂与还原剂物质的量之比;
(2)氯气氧化性强于溴,能够与溴化钾反应生成溴单质,溴水为橙色;
(3)氯气具有强的氧化性,与二价铁离子反应生成三价铁离子,三价铁离子与KSCN发生络合反应生成血红色络合物;
(4)氯气氧化性强于碘,能够与碘化钾反应生成碘单质,碘遇到淀粉变蓝;氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性;氯气不具有漂白性.
解答 解:(1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中锰元素化合价降解从+7价降为+2价,高锰酸钾做氧化剂,盐酸中氯元素化合价升高从-1价升高到0价,依据得失电子守恒规律,可知2mol高锰酸钾参加反应,需要有10mol氯化氢被氧化,所以氧化剂与还原剂的物质的量之比为:1:5;
故答案为:1:5;
(2)氯气氧化性强于溴,能够与溴化钾反应生成溴单质,离子方程式:Cl2+2Br-=2Cl-+Br2,溴水为橙色;
故答案为:橙; Cl2+2Br-=2Cl-+Br2;
(3)氯气具有强的氧化性,与二价铁离子反应生成三价铁离子,离子方程式:Cl2+2Fe2+=2Cl-+2Fe3+;三价铁离子与KSCN发生络合反应生成血红色络合物,离子方程式:Fe3++3SCN-=Fe(SCN)3;
故答案为:红;Cl2+2Fe2+=2Cl-+2Fe3+;Fe3++3SCN-=Fe(SCN)3;
(4)氯气氧化性强于碘,能够与碘化钾反应生成碘单质,碘遇到淀粉变蓝;氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,能够使蓝色石蕊试纸变红色,次氯酸具有漂白性,最终使试纸褪色;
氯气不具有漂白性,不能使干燥的石蕊试纸变色,
故答案为:蓝; 先变红后褪色; 无变化;
点评 本题考查了氯气的制备和性质检验,明确氯气制备原理和其氧化性是解题关键,题目难度不大.

 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | ①④②⑤③ | B. | ⑤②①④③ | C. | ②⑤④①③ | D. | ④①②⑤③ |
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
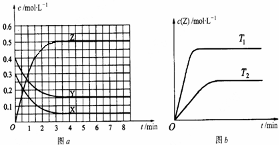
| A. | 该反应的正反应是放热反应 | |
| B. | T0时,该反应的平衡常数为$\frac{1}{3}$ | |
| C. | 反应时各物质的反应速率关系为:2v (X)=2v (Y)=v (Z) | |
| D. | 图a中反应达到平衡时,Y的转化率为37.5% |
| 编号 | Ⅰ | Ⅱ |
| 实验一 | 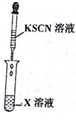  |  |
| 编号 | Ⅲ | |
| 实验二 |  | |
(2)实验步骤Ⅲ中反应的离子方程式为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中含Fe2+离子,实验Ⅱ证明X溶液中含Cl-离子.(填离子符号)
 [Al(OH)2]++H+.
[Al(OH)2]++H+.