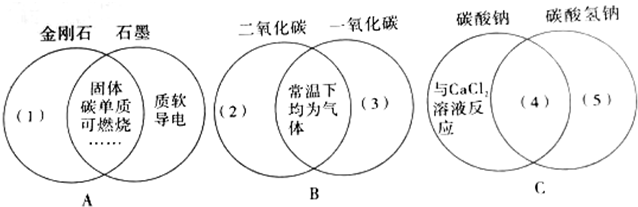
题目内容
8.常温下,下列溶液中各微粒浓度关系或pH判定不正确的是( )| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.酸是二元酸、碱是一元碱,二者体积、浓度相等,则物质的量相等,二者混合后酸有剩余,混合溶液中c(H+)=$\frac{0.02mol/L×0.005L×(2-1)}{0.005L×2}$=0.01mol/L,溶液的pH=-lgc(H+);
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.pH相同的不同弱酸钠盐溶液,酸根离子水解程度越大其溶液浓度越小;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.酸是二元酸、碱是一元碱,二者体积、浓度相等,则物质的量相等,二者混合后酸有剩余,混合溶液中c(H+)=$\frac{0.02mol/L×0.005L×(2-1)}{0.005L×2}$=0.01mol/L,溶液的pH=-lgc(H+)=-lg0.01=2,故A正确;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,说明水电离受抑制,则溶液中溶质为酸或碱,如果溶质为酸,则pH=14-a,如果溶质为碱,则pH=a,故B错误;
C.pH相同的不同弱酸钠盐溶液,酸根离子水解程度越大其溶液浓度越小,酸根离子水解程度C6H5O->HCO3->CH3COO-,则pH相同的钠盐浓度:①>③>②,钠离子不水解,所以c(Na+)大小关系:①>③>②,故C正确;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)+c(K+)=c(NO3-)+c(CH3COO-)+c(OH-),根据物料守恒得c(K+)=c(NO3-),所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,知道溶液中存在的电荷守恒及物料守恒,易错选项是BD,注意B中溶质可能是酸也可能是碱,题目难度不大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 溶质的质量分数为ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c (OH-)=$\frac{b}{V}$mol•L-1 | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
| A. | Na2CO3是发酵粉的主要成分之一 | B. | MgO常用作耐高温材料 | ||
| C. | 石灰石可用作工业炼铁的原料 | D. | 工业上可用Cl2制造漂白粉 |
| A. | NaBH4中B元素化合价为+3 | B. | 每生成11.2 L氏转移Na个电子 | ||
| C. | NaBH4在反应中作氧化剂 | D. | NH3BH3在反应中属于还原产物 |
| A. | Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原 | |
| B. | CuI既是氧化产物又是还原产物 | |
| C. | 每生成1 mol CuI,有12 mol KI发生氧化反应 | |
| D. | 每转移1.1 mol电子,有0.2 mol IO3-被氧化 |

 .
.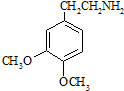 .
.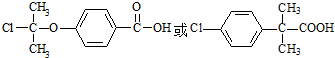 .
.