题目内容
13.固体储氢材料氨硼烷,化学式为NH3BH3,可用如下反应制取:Ni(NH3)6Cl2+2NaBH4=2NH3BH3+4NH3↑+2NaCl+H2↑+Ni.下列说法正确的是( )| A. | NaBH4中B元素化合价为+3 | B. | 每生成11.2 L氏转移Na个电子 | ||
| C. | NaBH4在反应中作氧化剂 | D. | NH3BH3在反应中属于还原产物 |
分析 反应中,化合物中B元素的化合价为+3价,Ni元素的化合价由+2价降低为0,H元素的化合价由-1价升高为0,以此来解答.
解答 解:A.NaBH4中Na为+1价,H为-1价,则由化合物中化合价的倒数和为0可知,B元素化合价为+3价,故A正确;
B.状况未知,不能利用体积计算物质的量及转移电子,故B错误;
C.NaBH4中H元素的化合价升高,反应中作还原剂,故C错误;
D.在反应中NH3BH3既不是氧化产物也不是还原产物,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重化合价判断、基本概念、氢键等知识点的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
3.下表中的事实与推论不符的是( )
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | HCl热稳定性比H2S强 | 非金属性:Cl>S |
| A. | A | B. | B | C. | C | D. | D |
4.下列说法正确的是( )
| A. | 固体NaCl不导电,所以NaCl是非电解质 | |
| B. | 蔗糖、酒精在水溶液和熔融状态时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
1.钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的主要流程图,已知钼酸难溶于水.
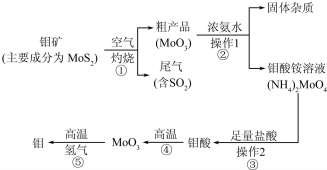
(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
根据表中提供的数据可知,在溶液中不能大量共存的微粒是
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).

(1)写出反应①的化学方程式:2MoS2+7O2$\frac{\underline{\;高温\;}}{\;}$2MoO3+4SO2 .
(2)写出反应②的化学方程式:MoO3+2NH3•H2O=(NH4)2MoO4.
(3)反应①的尾气可以用碳酸钠溶液吸收.已知
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
A.HCO3-、HSO3- B HCO3-、SO32-
C.HCO3-、H2SO3 D HSO3-、CO32-
向过量碳酸钠溶液中通人少量二氧化硫,写出反应的离子方程式:2CO32-+SO2+H2O=SO32-+2HCO3-.
(4)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有烧杯、漏斗、玻璃棒.
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4$\frac{\underline{\;高温\;}}{\;}$2CO+2H2,CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.含甲烷体积分数为80%的10L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为41.1g(小数点后保留1位,钼的相对原子质量为96).
8.常温下,下列溶液中各微粒浓度关系或pH判定不正确的是( )
| A. | 将5 mL 0.02 mol/L的H2SO4溶液与5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的体积为10 mL,则混合液的pH=2 | |
| B. | 某物质的溶液中由水电离的c(H+)=1×10-amol/L,若a>7,则pH一定为14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
3.原子序数依次增大的短周期主族元素a、b、c、d,它们的最外层电子数分别为1、4、1、4.a-的L层电子的电子数为0.下列说法正确的是( )
| A. | 元素b、c在同一周期 | |
| B. | 元素a、b、d各自最高和最低化合价的代数和均为0 | |
| C. | b的最高价氧化物对应的水化物酸性比d的弱 | |
| D. | 元素a、b、c不能存在于同一离子化合物中 |
 A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素
A、B、C、D、E为原子序数依次增大的短周期元素,B、C相邻且同周期,C原子中含有8种运动状态不同的电子.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.D是地壳中含量最多的金属元素.E元素为同周期电负性最大的元素.E和D可形成化合物丙.F为第四周期未成对电子数最多的元素