题目内容
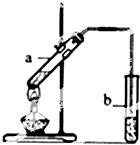 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.①试管a中生成乙酸乙酯的化学反应方程式是
②试管b中盛放的试剂是
③生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
考点:乙酸乙酯的制取
专题:实验题
分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应,据此写出反应的化学方程式;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;导管伸入液面以下会发生倒吸;试管b中碳酸钠与乙酸反应生成乙酸钠和水,据此写出反应的离子方程式;
(3)当可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率等于化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化.
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;导管伸入液面以下会发生倒吸;试管b中碳酸钠与乙酸反应生成乙酸钠和水,据此写出反应的离子方程式;
(3)当可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率等于化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化.
解答:
解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸,便于闻乙酸乙酯的香味,降低乙酸乙酯的溶解度,便于分层;
试管b中的导管伸入液面下会发生倒吸现象,所以试管b不能伸入液面以下;
强酸制弱酸,书写离子方程式时,乙酸是弱酸用化学式,方程式为CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O,
故答案为:饱和碳酸钠溶液;防止倒吸;CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O;
(3)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确,
故答案为:②④⑤.
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸,便于闻乙酸乙酯的香味,降低乙酸乙酯的溶解度,便于分层;
试管b中的导管伸入液面下会发生倒吸现象,所以试管b不能伸入液面以下;
强酸制弱酸,书写离子方程式时,乙酸是弱酸用化学式,方程式为CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O,
故答案为:饱和碳酸钠溶液;防止倒吸;CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O;
(3)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确,
故答案为:②④⑤.
点评:本题考查乙酸乙酯的制备、化学平衡状态的判断,是一道实验综合题,知识点较多,难度不大,注意掌握乙酸乙酯的制备方法及反应原理,明确化学平衡状态的判断方法,试题考查了学生分析问题的能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知T℃时,水的离子积常数为Kw.该温度下,将等浓度的一元酸HA与一元碱BOH等体积混合,下列描述正确的是( )
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
下列关于元素电负性大小的比较中,不正确的是( )
| A、Se<Te<S<O |
| B、C<N<O<F |
| C、P<S<O<F |
| D、K<Na<Mg<Al |
下列原子中,核外电子层数与最外层电子数互不相等的是( )
| A、H | B、Be | C、Mg | D、Al |
下列实验中,金属或固体可以完全溶解的是( )
| A、在H2O2溶液中加入少量MnO2粉末 |
| B、镀锌铁皮加入足量的NaOH溶液中 |
| C、1mol铜片与含2mol H2SO4的浓硫酸共热 |
| D、常温下,1mol铜片投入含4mol HNO3的浓硝酸中 |
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表: