题目内容
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-现将它们分别配成0.1mol?L-1的溶液,进行如下实验:①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
根据上述实验现象,回答下列问题:
(1)实验②中反应的用离子方程式表示沉淀消失的原因 ;
(2)写出下列3种化合物的化学式:A 、C 、E .
(3)实验④中反应的用化学方程式表示沉淀变色的原因 .
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色.
根据上述实验现象,回答下列问题:
(1)实验②中反应的用离子方程式表示沉淀消失的原因
(2)写出下列3种化合物的化学式:A
(3)实验④中反应的用化学方程式表示沉淀变色的原因
考点:无机物的推断
专题:推断题,物质检验鉴别题
分析:①测得溶液A、C、E呈碱性,三种溶液为碱液或水解呈碱性的溶液,且碱性为A>E>C,则A为碱,溶液中含有大量的OH-离子,OH-离子与Ag+,Ca2+,Fe2+,Al3+等离子不能大量共存,故A只能为Ba(OH)2,根据越弱越水解,E应为碳酸盐,根据离子共存,只能为K2CO3,C为醋酸盐;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则B中含有银离子,应为硝酸银溶液,加入氨水发生的反应为AgNO3+NH3?H2O=AgOH↓+NH4NO3;
AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明B中不含SO42-离子;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色,说明F中含有Fe2+离子;
综上分析可知,A为Ba(OH)2,B为AgNO3,C为Ca(CH3COO)2,D为AlCl3,E为K2CO3,F为FeSO4,以此解答该题.
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则B中含有银离子,应为硝酸银溶液,加入氨水发生的反应为AgNO3+NH3?H2O=AgOH↓+NH4NO3;
AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明B中不含SO42-离子;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色,说明F中含有Fe2+离子;
综上分析可知,A为Ba(OH)2,B为AgNO3,C为Ca(CH3COO)2,D为AlCl3,E为K2CO3,F为FeSO4,以此解答该题.
解答:
解:①测得溶液A、C、E呈碱性,三种溶液为碱液或水解呈碱性的溶液,且碱性为A>E>C,则A为碱,溶液中含有大量的OH-离子,OH-离子与Ag+,Ca2+,Fe2+,Al3+等离子不能大量共存,故A只能为Ba(OH)2,根据越弱越水解,E应为碳酸盐,根据离子共存,只能为K2CO3,C为醋酸盐;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则B中含有银离子,应为硝酸银溶液,加入氨水发生的反应为AgNO3+NH3?H2O=AgOH↓+NH4NO3;
AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明B中不含SO42-离子;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色,说明F中含有Fe2+离子;
综上分析可知,A为Ba(OH)2,B为AgNO3,C为Ca(CH3COO)2,D为AlCl3,E为K2CO3,F为FeSO4.
(1)实验②中反应的离子方程式为Ag++NH3?H2O=AgOH↓+NH4+,AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O,
故答案为:Ag++NH3?H2O=AgOH↓+NH4+,AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O;
(2)根据以上分析可知A为Ba(OH)2,C为Ca(CH3COO)2,E为K2CO3,
故答案为:Ba(OH)2;Ca(CH3COO)2;K2CO3;
(3)F为FeSO4,加入氨水生成Fe(OH)2,不稳定,易被氧化生成Fe(OH)3,发生反应的化学方程式有:FeSO4+2NH3?H2O=Fe(OH)2↓+(NH4)2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失,则B中含有银离子,应为硝酸银溶液,加入氨水发生的反应为AgNO3+NH3?H2O=AgOH↓+NH4NO3;
AgOH+2NH3?H2O=Ag(NH3)2OH+2H2O;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象,说明B中不含SO42-离子;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色,说明F中含有Fe2+离子;
综上分析可知,A为Ba(OH)2,B为AgNO3,C为Ca(CH3COO)2,D为AlCl3,E为K2CO3,F为FeSO4.
(1)实验②中反应的离子方程式为Ag++NH3?H2O=AgOH↓+NH4+,AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O,
故答案为:Ag++NH3?H2O=AgOH↓+NH4+,AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O;
(2)根据以上分析可知A为Ba(OH)2,C为Ca(CH3COO)2,E为K2CO3,
故答案为:Ba(OH)2;Ca(CH3COO)2;K2CO3;
(3)F为FeSO4,加入氨水生成Fe(OH)2,不稳定,易被氧化生成Fe(OH)3,发生反应的化学方程式有:FeSO4+2NH3?H2O=Fe(OH)2↓+(NH4)2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查离子共存、无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目难度较大,注意从物质的性质以及反应现象推断,熟练掌握元素化合物的性质.

练习册系列答案
相关题目
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-═Al(OH)3 |
| B、以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH- |
| D、钢铁发生吸氧腐蚀的正极反应式:Fe-2e-═Fe2+ |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |
下列说法正确的是( )
| A、在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B、由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C、基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D、所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
有一无色溶液,仅含有K+、Al3+、Mg2+、NH
、Cl-、SO
、HCO
、MnO
中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
+ 4 |
2- 4 |
- 3 |
- 4 |
A、肯定有Al3+、Mg2+、Cl-,可能有NH
| ||||||||
B、肯定有Al3+、K+、Cl-,肯定没有MnO
| ||||||||
C、肯定有Al3+、Cl-,一定没有HCO
| ||||||||
| D、该溶液可能显弱酸性,也可能显中性 |
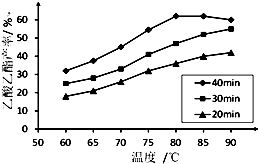 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: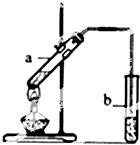 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.