题目内容
下列实验中,金属或固体可以完全溶解的是( )
| A、在H2O2溶液中加入少量MnO2粉末 |
| B、镀锌铁皮加入足量的NaOH溶液中 |
| C、1mol铜片与含2mol H2SO4的浓硫酸共热 |
| D、常温下,1mol铜片投入含4mol HNO3的浓硝酸中 |
考点:铜金属及其重要化合物的主要性质,铁的化学性质
专题:几种重要的金属及其化合物
分析:A、二氧化锰是过氧化氢分解的催化剂,质量和化学性质不变;
B、铁与NaOH溶液不反应;
C、铜与浓硫酸加热反应反应随反应进行变化为稀硫酸不与铜反应;
D、铜和浓硝酸反应生成硝酸铜,二氧化氮和水,浓硝酸变稀后继续反应生成硝酸铜,一氧化氮和水.
B、铁与NaOH溶液不反应;
C、铜与浓硫酸加热反应反应随反应进行变化为稀硫酸不与铜反应;
D、铜和浓硝酸反应生成硝酸铜,二氧化氮和水,浓硝酸变稀后继续反应生成硝酸铜,一氧化氮和水.
解答:
解:A、MnO2作催化剂,反应前后保持不变,故A错误;
B、铁与NaOH溶液不反应,故B错误;
C、1 mol铜片与含2 mol H2SO4的浓硫酸共热理论上恰好完全反应,但随着反应的进行硫酸变稀,反应不再进行,故C错误;
D、常温下1 mol铜片投人含4 mol HNO3的浓硝酸中,铜和浓硝酸反应生成硝酸铜,二氧化氮和水,Cu+4HNO3=Cu(NO3)2+NO2↑+2H2O,浓硝酸变稀后继续反应,生成硝酸铜,一氧化氮和水,铜全部溶解,故D正确;
故选D.
B、铁与NaOH溶液不反应,故B错误;
C、1 mol铜片与含2 mol H2SO4的浓硫酸共热理论上恰好完全反应,但随着反应的进行硫酸变稀,反应不再进行,故C错误;
D、常温下1 mol铜片投人含4 mol HNO3的浓硝酸中,铜和浓硝酸反应生成硝酸铜,二氧化氮和水,Cu+4HNO3=Cu(NO3)2+NO2↑+2H2O,浓硝酸变稀后继续反应,生成硝酸铜,一氧化氮和水,铜全部溶解,故D正确;
故选D.
点评:本题考查了金属性质的分析判断,主要是浓度变化,反应进行程度的分析应用,掌握反应条件,反应定量关系和反应实质是关键,题目难度中等.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、在熔融状态下,lmol NaHSO4完全电离出的阳离子数为2NA |
| C、5.6 g铁粉在2.24L(标准状况)氯气中充分燃烧,失去的电子数为0.3NA |
| D、78g Na2O2固体与H2O完全反应转移的电子数为NA |
某元素电子构型为[Xe]4f46s2,其应在( )
| A、s区 | B、p区 | C、d区 | D、f区 |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀H2SO4,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法正确的是( )
| A、若向该溶液中加入足量的NaOH溶液,充分反应后过滤、洗涤、灼烧,最终所得固体质量为72g |
| B、若向该溶液中加入过量的稀H2SO4,产生的气体遇空气能变成红棕色 |
| C、若向该溶液中加入过量的稀H2SO4和KSCN溶液,溶液不显血红色 |
| D、该溶液中所含的离子是:Fe2+、Ba2+、SO42-、NO3- |
 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以如图所示框图进行反应.下列说法中正确的是( )
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以如图所示框图进行反应.下列说法中正确的是( )| A、A、B、C三种元素中的任意两种元素形成的化合物所属物质类别可能是氧化物 |
| B、A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是碱 |
| C、如果E溶液是一种强酸,则E溶液为硫酸 |
| D、A、B、C三种元素中有一种金属且为B |
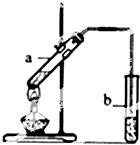 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.