题目内容
下列关于元素电负性大小的比较中,不正确的是( )
| A、Se<Te<S<O |
| B、C<N<O<F |
| C、P<S<O<F |
| D、K<Na<Mg<Al |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小.
解答:
解:A、元素的非金属性越强,电负性越强,元素的非金属性:Te<Se<S<O,则电负性为Te<Se<S<O,故A错误;
B、同周期自左而右电负性增大,故电负性C<N<O<F,故B正确;
C、同一周期元素从左到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故C正确;
D、一般来说,元素非金属性越强电负性越小,金属性越强,电负性越小,即K<Na<Mg<Al,故D正确;
故选A.
B、同周期自左而右电负性增大,故电负性C<N<O<F,故B正确;
C、同一周期元素从左到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故C正确;
D、一般来说,元素非金属性越强电负性越小,金属性越强,电负性越小,即K<Na<Mg<Al,故D正确;
故选A.
点评:本题考查了元素周期律的应用,为高考常见题型,难度不大,可根据元素周期律的有关知识进行解答,注意基础知识的积累.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下列说法中,正确的是( )
| A、化学家可以制造出自然界中不存在的物质 |
| B、化学研究的主要目的就是认识分子 |
| C、化学科学与其他科学分支的联系不密切 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
2CO(g)═2C(s)+O2(g)△H=+221kJ?mol-1
则反应TiO2(s)+2Cl2(g)+2C(s)═TiCl4(l)+2CO(g)△H为( )
| A、-162 kJ?mol-1 |
| B、+81 kJ?mol-1 |
| C、+162 kJ?mol-1 |
| D、-81 kJ?mol-1 |
已知X、Y是主族元素,I为电离能,单位是kJ?mol-1.请根据下表所列数据判断,错误的是( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 502 | 4 600 | 6 900 | 9 500 |
| Y | 588 | 1 820 | 2 750 | 11 600 |
| A、元素X的常见化合价是+1 |
| B、若元素Y处于第3周期,它可与冷水剧烈反应 |
| C、元素Y是ⅢA族元素 |
| D、元素X与氯形成化合物时,化学式可能是XCl |
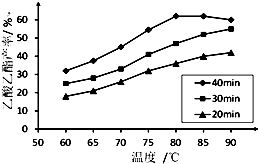 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: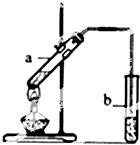 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.