题目内容
 碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容积不变的密闭真空容器(容器容积为3L,固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如下:
| n/mol t/min |
NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②根据表中数据,计算T1℃时该反应的平衡常数为
③下列各项能判断该反应达到平衡状态的是
A.容器内压强保持不变 B. 2v(NO)(正)=v(N2)(逆)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率
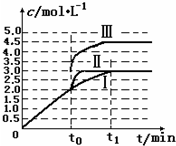
(4)在3L容积可变的密闭容器中发生反应H2(g)+CO2(g)═H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.若在t0时分别改变一个条件,曲Ⅰ变成曲线Ⅱ和曲线Ⅲ.
①当曲线Ⅰ变成曲线Ⅱ时,改变的条件是
②当曲线Ⅰ变成曲线Ⅲ时,改变的条件及改变条件的变化量分别是
考点:物质的量或浓度随时间的变化曲线,化学平衡建立的过程,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)燃烧热为1mol物质完全燃烧生成温度氧化物的热效应,故可计算1molC2H2完全燃烧生成液态水和二氧化碳气体放出的热量,写出热化学方程式;
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,利用C元素化合价变化判断失去电子数,根据电荷守恒和质量守恒写出电极反应式;
(3)①计算10min~20min内,NO浓度的变化,得到v(NO);
②20min后达到化学平衡状态,利用化学平衡常数表达式计算,化学平衡常数;
③利用化学平衡状态的特征判断;
④NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变;
(4)①根据曲线中c(CO)变化所需时间进行判断;
②曲线Ⅰ变成曲线Ⅲ,CO浓度增大,由于反应前后气体体积不变,可以减小体积或者增大压强考虑,结合平衡状态时,CO的浓度之比,计算出体积减小或者压强增大的倍数.
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,利用C元素化合价变化判断失去电子数,根据电荷守恒和质量守恒写出电极反应式;
(3)①计算10min~20min内,NO浓度的变化,得到v(NO);
②20min后达到化学平衡状态,利用化学平衡常数表达式计算,化学平衡常数;
③利用化学平衡状态的特征判断;
④NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变;
(4)①根据曲线中c(CO)变化所需时间进行判断;
②曲线Ⅰ变成曲线Ⅲ,CO浓度增大,由于反应前后气体体积不变,可以减小体积或者增大压强考虑,结合平衡状态时,CO的浓度之比,计算出体积减小或者压强增大的倍数.
解答:
解:(1)2.00g的C2H2的物质的量为
=0.077mol,释放热量99.6kJ,则C2H2的燃烧热为
=1294.8 kJ/mol,可写出热化学方程式:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol,
故答案为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol;
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,C元素化合价升高了5,即1molC2H2失去10mole-,电极反应式为:C2H2-10e-+14OH-=2CO32-+8H2O,故答案为:C2H2-10e-+14OH-=2CO32-+8H2O;
(3)①10min~20min内,NO浓度的变化为
=0.12mol/L,v(NO)=
=0.012mol/(L?min),故答案为:0.012mol/(L?min);
②20min后达到化学平衡状态,由于C为固体,化学平衡常数表达式为
=
=0.56,故答案为:0.56;
③A.反应前后气体体积不变,是否达到平衡状态,压强都不发生变化,故A错误;
B.2v(NO)(正)=v(N2)(逆),速率之比等于计量数之比可知,v(N2)(逆)=
v(NO)(逆),即v(NO)(正)=
v(NO)(逆),未达到平衡状态,故B错误;
C.容器内CO2的体积分数不变,则各物质浓度不再发生变化,达到化学平衡状态,故C正确;
D.ρ=
,气体物质的量不变,由于C为固体,则气体总质量m,随着反应进行会发生变化,即密度也会发生变化,当密度不变时,达到化学平衡状态,故D正确;
故选:CD;
④NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变,则NO的转化率也不变,故答案为:不变;
(4)①曲线Ⅰ变成曲线Ⅱ时,CO平衡浓度不变,达到平衡所需时间减小,加快了反应速率,可以是加入催化剂,故答案为:加入催化剂;
②曲线Ⅰ变成曲线Ⅲ,CO浓度增大,由于反应前后气体体积不变,减小体积或者增大压强都可以达到目的;曲线Ⅰ达平衡时c(CO)=3.0mol?L-1,曲线Ⅲ达平衡时c(CO)=4.5mol?L-1,浓度增大为原来的
=1.5倍,则压强增大为原来的1.5倍,故答案为:增大压强,压强变为原来的1.5.
| 2g |
| 26g/mol |
| 99.6kJ |
| 0.077mol |
| 5 |
| 2 |
故答案为:C2H2(g)+
| 5 |
| 2 |
(2)原电池负极发生氧化反应,电解质溶液为氢氧化钾溶液,C2H2放电生成2CO32-,C元素化合价升高了5,即1molC2H2失去10mole-,电极反应式为:C2H2-10e-+14OH-=2CO32-+8H2O,故答案为:C2H2-10e-+14OH-=2CO32-+8H2O;
(3)①10min~20min内,NO浓度的变化为
| 1.16mol-0.80mol |
| 3L |
| 0.12mol/L |
| 20mim-10min |
②20min后达到化学平衡状态,由于C为固体,化学平衡常数表达式为
| c(N2)?c(CO2) |
| c2(NO) |
| ||||
(
|
③A.反应前后气体体积不变,是否达到平衡状态,压强都不发生变化,故A错误;
B.2v(NO)(正)=v(N2)(逆),速率之比等于计量数之比可知,v(N2)(逆)=
| 1 |
| 2 |
| 1 |
| 4 |
C.容器内CO2的体积分数不变,则各物质浓度不再发生变化,达到化学平衡状态,故C正确;
D.ρ=
| m |
| n |
故选:CD;
④NO的起始浓度增大,体系压强增大,由于反应前后气体体积不变,化学平衡状态不变,则NO的转化率也不变,故答案为:不变;
(4)①曲线Ⅰ变成曲线Ⅱ时,CO平衡浓度不变,达到平衡所需时间减小,加快了反应速率,可以是加入催化剂,故答案为:加入催化剂;
②曲线Ⅰ变成曲线Ⅲ,CO浓度增大,由于反应前后气体体积不变,减小体积或者增大压强都可以达到目的;曲线Ⅰ达平衡时c(CO)=3.0mol?L-1,曲线Ⅲ达平衡时c(CO)=4.5mol?L-1,浓度增大为原来的
| 4.5 |
| 3 |
点评:本题较为综合,考查了热化学方程式的书写、化学平衡常数、化学平衡状态的判断已经化学平衡移动,难度中等,其中(4)为图象题,具有一定难度.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
A、B、C、D是同一周期的四种主族元素,A和B的最高价氧化物对应的水化物显碱性,且碱性B>A;C、D两种元素对应的气态氢化物的稳定性C>D,则它们的原子序数由小到大的顺序是( )
| A、B<A<C<D |
| B、A<B<C<D |
| C、B<A<C<D |
| D、B<A<D<C |
下列实验操作中,不能达到实验目的是( )
| A、溴乙烷与氢氧化钠溶液共煮后,加入硝酸银溶液检验Br- |
| B、用电石与饱和食盐水制乙炔 |
| C、用苯、浓硝酸和18.4mol/L的硫酸制硝基苯 |
| D、用稀硝酸洗涤做过银镜反应的试管 |
在标准状况下,1mol二氧化碳的体积约为( )
| A、28L | B、11.2L |
| C、22.4L | D、5.6L |