题目内容
由Zn-Cu-硫酸溶液组成的原电池,工作一段时间后,锌片的质量减少了6.5g.回答下列问题:
(1)上述原电池的正极是: ,电极反应式: .
(2)若将电解质溶液改为硫酸铜溶液,负极是: ,电极反应式: .当电池输出相同的电量时,电池两极的质量差为 .
(1)上述原电池的正极是:
(2)若将电解质溶液改为硫酸铜溶液,负极是:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的阳离子得电子;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极;根据转移电子相等计算生成氢气的体积,根据转移电子相同计算阴极上生成铜的质量,两个电极的差为减少的锌的质量与析出铜质量的和.
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极;根据转移电子相等计算生成氢气的体积,根据转移电子相同计算阴极上生成铜的质量,两个电极的差为减少的锌的质量与析出铜质量的和.
解答:
解:(1)活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的氢离子得电子生成氢气,2H++2e-=H2↑;
故答案为:Cu;2H++2e-=H2↑;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;电解硫酸铜溶液时,根据转移电子相等得析出铜的质量=
=6.4g,两个电极的差为减少的锌的质量与析出铜质量的和,所以两个电极的质量差=6.5g+6.4g=12.9g;
故答案为:Zn;Zn-2e-=Zn2+;12.9g.
故答案为:Cu;2H++2e-=H2↑;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;电解硫酸铜溶液时,根据转移电子相等得析出铜的质量=
| 6.5g |
| 65g/mol |
故答案为:Zn;Zn-2e-=Zn2+;12.9g.
点评:本题考查原电池的工作原理,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某短周期元素原子最外层有2个电子,则( )
| A、一定是ⅡA族元素 |
| B、其最外层电子已形成了稳定结构 |
| C、一定是镁元素 |
| D、可能是氦元素或ⅡA族元素 |
下列说法正确的是( )
| A、同温同压下甲烷和氧气的密度之比为2:1 |
| B、1 g甲烷和1 g氧气的原子数之比为5:1 |
| C、等物质的量的甲烷和氧气的质量之比为2:1 |
| D、在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
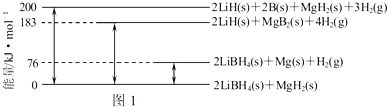
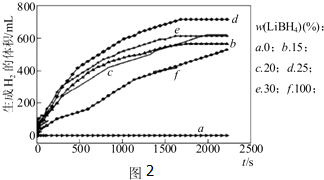
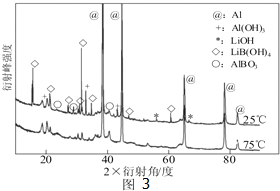
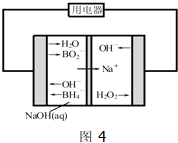
 碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.