题目内容
已知2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),在一个有催化剂且容积为vL的恒容容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为ω mol?L-1,放出热量b kJ.
(1)比较a b(填“>”“=”或“<”).
(2)写出b与a、ω、v间的函数关系式:
(3)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”).
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是 .
a.及时分离出C3气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)若上述反应是发生在一个初始容积为V L的恒压容器中,则相同温度下达到平衡所需的时间 (变长、变短),平衡时反应物的转化率 (增大、减小)
(1)比较a
(2)写出b与a、ω、v间的函数关系式:
(3)若将反应温度升高到700℃,该反应的平衡常数将
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C3气体 b.适当升高温度 c.增大B2的浓度 d.选择高效的催化剂
(5)若上述反应是发生在一个初始容积为V L的恒压容器中,则相同温度下达到平衡所需的时间
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)可逆反应不能完全反应,参加反应的A的物质的量小于2mol;
(2)依据热化学方程式定量关系 计算得到b与a、ω、v间的函数关系式;
(3)反应是放热反应,升温平衡逆向进行;
(4)依据影响反应速率和平衡的因素,结合反应特征分析选项;
(5)反应是气体体积减小的反应,恒温恒压条件下随反应进行,压强减小,为保持恒压体积减小压强增大,平衡正向进行反应速率大,达到平衡时间短,反应物的转化率增大.
(2)依据热化学方程式定量关系 计算得到b与a、ω、v间的函数关系式;
(3)反应是放热反应,升温平衡逆向进行;
(4)依据影响反应速率和平衡的因素,结合反应特征分析选项;
(5)反应是气体体积减小的反应,恒温恒压条件下随反应进行,压强减小,为保持恒压体积减小压强增大,平衡正向进行反应速率大,达到平衡时间短,反应物的转化率增大.
解答:
解:(1)在一个有催化剂的固定容积的容器中加入2mol A和1mol B,在500℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ,反应是可逆反应,不能进行彻底,反应放出的热量小于焓变数值,a>b,
故答案为:>;
(2)在一个有催化剂且容积为vL的恒容容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为ω mol?L-1,物质的量为wvmol,放出热量b kJ,
2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),
2 mol 1mol 2mol aKJ
wvmol bKJ
得到b=a?v?
;
故答案为:b=a?v?
;
(3)反应是放热反应,若将反应温度升高到700℃,平衡逆向进行,该反应的平衡常数将减小,故答案为:减小;
(4)为使该反应的反应速率增大,且平衡向正反应方向移动,则
a.及时分离出C3气体,生成物浓度减小,反应速率减小,平衡正向进行,故a错误;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b错误;
c.增大B2的浓度,增大反应速率,平衡正向进行,故c正确;
d.选择高效的催化剂改变反应速率但不改变化学平衡,故d错误;
故答案为:c;
(5)2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1,反应是气体体积减小的反应,恒温恒压条件下随反应进行压强减小,为保持恒压体积减小压强增大,平衡正向进行反应速率大,达到平衡时间短,反应物的转化率增大,故答案为:变短;增加.
故答案为:>;
(2)在一个有催化剂且容积为vL的恒容容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为ω mol?L-1,物质的量为wvmol,放出热量b kJ,
2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1(a>0),
2 mol 1mol 2mol aKJ
wvmol bKJ
得到b=a?v?
| w |
| 2 |
故答案为:b=a?v?
| w |
| 2 |
(3)反应是放热反应,若将反应温度升高到700℃,平衡逆向进行,该反应的平衡常数将减小,故答案为:减小;
(4)为使该反应的反应速率增大,且平衡向正反应方向移动,则
a.及时分离出C3气体,生成物浓度减小,反应速率减小,平衡正向进行,故a错误;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b错误;
c.增大B2的浓度,增大反应速率,平衡正向进行,故c正确;
d.选择高效的催化剂改变反应速率但不改变化学平衡,故d错误;
故答案为:c;
(5)2A2(g)+B2(g)?2C3(g)△H=-a kJ?mol-1,反应是气体体积减小的反应,恒温恒压条件下随反应进行压强减小,为保持恒压体积减小压强增大,平衡正向进行反应速率大,达到平衡时间短,反应物的转化率增大,故答案为:变短;增加.
点评:本题考查了影响反应速率、化学平衡的因素分析判断,注意反应焓变的意义理解和计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知一个12C原子的质量为ag,一个X原子的质量为bg,阿伏加德罗常数为NAmol-1,则X的相对原子质量为( )
A、12
| ||
B、12
| ||
C、
| ||
| D、bNA |
下列实验式中,没有相对分子质量就可以确定分子式的是( )
①CH3 ②CH ③CH2 ④C2H5.
①CH3 ②CH ③CH2 ④C2H5.
| A、①② | B、③④ | C、②③ | D、①④ |
党的十八大报告中提出,要大力推进生态文明建设,坚持节约资源和保护环境.下列做法符合报告要求的是( )
| A、采用焚烧或深埋的方法处理垃圾 |
| B、推广使用太阳能、风能等新能源 |
| C、提高煤和石油的产量以满足社会对能源的需求 |
| D、将未经处理的工业废水直接排入江河湖泊 |
在可逆反应2A(g)+3B(g)?xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol?L-1,B为3mol?L-1,前2min内C的平均反应速率为0.5mol?L-1?min-1.2min后,测得D的浓度为0.5mol?L-1.则关于此反应的下列说法中正确的是( )
| A、2 min末时A和B的浓度之比为5:3 |
| B、x=2 |
| C、2 min末时B的浓度为1.5 mol?L-1 |
| D、2 min末时A的消耗浓度为0.5 mol?L-1 |
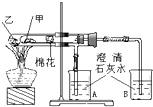 如图是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图实验装置、分析实验原理,并判断下列说法和做法,其中不科学的是( )
如图是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察如图实验装置、分析实验原理,并判断下列说法和做法,其中不科学的是( )| A、甲为小苏打,乙为纯碱 |
| B、整个实验过程中没有发现A烧杯的澄清石灰水变浑浊 |
| C、加热不久就能看到A烧杯的澄清石灰水变浑浊 |
| D、要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球 |
将10.6g由Mg、Al、Si组成的合金投入足量的NaOH溶液中,在标准状况下产生气体11.2L;另取等质量的合金溶于过量稀H2SO4中,合金质量减少了7.8g.则合金中Mg、Al、Si的物质的量之比为( )
| A、1:2:1 |
| B、2:1:1 |
| C、1:3:2 |
| D、1:1:2 |
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |