题目内容
在可逆反应2A(g)+3B(g)?xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5mol?L-1,B为3mol?L-1,前2min内C的平均反应速率为0.5mol?L-1?min-1.2min后,测得D的浓度为0.5mol?L-1.则关于此反应的下列说法中正确的是( )
| A、2 min末时A和B的浓度之比为5:3 |
| B、x=2 |
| C、2 min末时B的浓度为1.5 mol?L-1 |
| D、2 min末时A的消耗浓度为0.5 mol?L-1 |
考点:化学平衡的计算
专题:化学平衡专题
分析:根据化学反应速率之比等于系数之比,结合化学反应的三段式计算:
A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
结合初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v=
.
A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
结合初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v=
| △c |
| △t |
解答:
解:2A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
A、2min末时,A和B的浓度之比为4:1.5=8:3,故A错误;
B、C的反应速率为
mol/(L?min)=0.5mol/(L?min),解得x=2,故B正确;
C、2min末时,B的浓度=1.5mol/L,故C正确;
D、2min末时,A的消耗浓度为1mol/L,故D错误.
故选BC.
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
A、2min末时,A和B的浓度之比为4:1.5=8:3,故A错误;
B、C的反应速率为
| 0.5x |
| 2min |
C、2min末时,B的浓度=1.5mol/L,故C正确;
D、2min末时,A的消耗浓度为1mol/L,故D错误.
故选BC.
点评:本题考查学生有关化学平衡和化学反应速率的有关计算知识,属于考查的重点内容,注意三行式在解题中的灵活应用,难度不大.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| B、大理石与稀盐酸反应制备二氧化碳:CO32-+2H+═CO2↑+H2O |
| C、碳酸钠溶液与过量的醋酸溶液反应:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
| D、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
有机物A的相对分子质量为222,1mol A完全水解得到1mol乙酸、1mol B、1mol C,B是一种芳香族化合物,其分子式为C8H8O3,下列说法正确的是( )
| A、B中一定含有羧基和羟基 |
| B、B中一定含有羧基 |
| C、B中可能含有醛基 |
| D、B中一定不含羟基 |
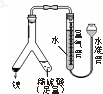 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、可用来测定镁的相对原子质量 |
| C、读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高 |
| D、金属镁中含有少量杂质铝,可导致测定结果偏高 |
下列关于水体污染及防治的说法正确的是( )
| A、N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
| B、只要不喝被重金属污染的水就不会中毒,因此水中的重金属污染对人类影响不大 |
| C、用熟石灰处理钢铁厂的酸性废水,利用的是复分解反应原理 |
| D、用Na2S处理含Hg2+废水使Hg2+变成HgS沉淀而除去,利用的是氧化还原反应原理 |
(双项)化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、绿色化学的核心是从源头上控制污染 |
| C、实现化石燃料清洁利用,就无需开发新能源 |
| D、垃圾是放错地方的资源,应分类回收利用 |