题目内容
2.硼有两种天然同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,硼元素的近似相对原子质量为10.80,则${\;}_{5}^{11}$B的质量百分比是( )| A. | 80% | B. | 大于80% | C. | 小于80% | D. | 无法计算 |
分析 硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,再根据$\overline{M}$=$\frac{m}{n}$计算其物质的量之比,利用物质的量计算其质量百分比.
解答 解:硼元素的相对原子质量是10.8,则硼元素的摩尔质量是10.8g/mol,
设10B和11B的物质的量分别是xmol、ymol,则$\frac{10g/mol×xmol+11g/mol×ymol}{(x+y)mol}$=10.8g/mol,
解得x:y=1:4,设10B和11B的物质的量分别是1mol、4mol,
则115B的质量百分比是$\frac{4mol×11g/mol}{4mol×11g/mol+1mol×10g/mol}$×100%≈81.5%,
故选B.
点评 本题考查物质的量的计算,把握元素的平均摩尔质量及物质的量比等于原子个数比为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3. 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠证明铁的还原性比钠强 | |
| C. | 若用戴维法与盖•吕萨克法制得等量的钠,则两反应各自转移的电子数相同 | |
| D. | 电解熔融氯化钠制钠的电解槽中(如上图),石墨为阳极,铁为阴极 |
10.21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |
17.在基态多电子原子中,关于核外电子能量的叙述错误的是( )
| A. | 同一能层的px、py、pz轨道电子能量相同 | |
| B. | 3d3表示3d能级有3个轨道 | |
| C. | p轨道电子能量不一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
7.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应A(s)+2B(g)?C(g)+D(g)已达到平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 气体的平均摩尔质量 | D. | 反应物A的质量 |
11.下列有关元素周期表说法正确的是( )
| A. | 第 IA族元素都是碱金属元素 | |
| B. | 元素原子的最外层电子数等于它的族序数 | |
| C. | 最外层电子数相同的元素不一定在同一个族 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
12.将10molA和5molB放入10L真空容器内,某温度下发生反应:3A(g)+B(g)?2C(g),在最初的2min内,消耗A 3.6mol,则在2min时,C的平均速率是( )
| A. | 0.12mol/(L•min) | B. | 0.18 mol/(L•min) | C. | 1.8 mol/(L•min) | D. | 1.2mol/(L•min) |
 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.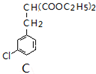 $\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$
$\underset{\stackrel{①O{H}^{-},②{H}_{3}{O}^{+}}{→}}{③△}$D$\stackrel{SOCl_{2}}{→}$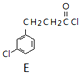 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$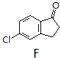
 或
或 (任写一种).
(任写一种). .
.