题目内容
12.计算题:将0.2molMg、Al的混合物用盐酸完全溶解,放出标准状况下5.6L气体,然后再滴入2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量?(写计算过程)
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V=250mL.
(3)若该Mg、Al混合物溶于200mL 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为350mL.
分析 镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,则$\left\{\begin{array}{l}{x+y=0.2}\\{x+1.5y=\frac{5.6}{22.4}}\end{array}\right.$,解之得x=0.1,y=0.1,加入NaOH溶液,可发生Mg2++20H-=Mg(OH)2↓、Al3++30H-=Al(OH)3↓,如NaOH过量,则发生Al3++40H-=AlO2-+2H2O,结合反应的离子方程式计算.
解答 解:(1)镁铝合金与盐酸发生:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,设合金中Mg为xmol,Al为ymol,则$\left\{\begin{array}{l}{x+y=0.2}\\{x+1.5y=\frac{5.6}{22.4}}\end{array}\right.$,解之得x=0.1,y=0.1,答:混合物中Mg、Al的物质的量为n(Mg)=0.1mol、n(Al)=0.1mol;
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,
则发生:Mg2++20H-=Mg(OH)2↓、Al3++30H-=Al(OH)3↓,
则需要n(NaOH)=2n(Mg)+3n(Al)=2×0.1mol+3×0.1mol=0.5mol,
V(NaOH)=$\frac{0.5mol}{2mol/L}$=0.25L=250mL,
故答案为:250;
(3)若该Mg、Al混合物溶于200mL 3mol/L盐酸后,n(HCl)=0.2L×3mol/L=0.6mol,消耗n(HCl)=2n(Mg)+3n(Al)=2×0.1mol+3×0.1mol=0.5mol,
剩余HCl0.6mol-0.5mol=0.1mol,
滴入NaOH溶液,使所得沉淀中无Al(OH)3,
则发生H++0H-=H2O,Mg2++20H-=Mg(OH)2↓、Al3++40H-=AlO2-+2H2O,
则需要n(NaOH)=n(HCl)+2n(Mg)+4n(Al)=0.1mol+2×0.1mol+4×0.1mol=0.7mol,
V(NaOH)=$\frac{0.7mol}{2mol/L}$=0.35L=350mL,
故答案为:350.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系、氢氧化铝的两性等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

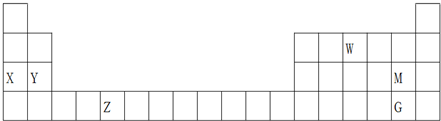
| A. | 最高价氧化物的水化物的碱性:X<Y | |
| B. | W的氢化物的球棍模型为: | |
| C. | 酸性:HMO4<HGO4 | |
| D. | Z的某些化合物可以用作反应的催化剂 |
 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠证明铁的还原性比钠强 | |
| C. | 若用戴维法与盖•吕萨克法制得等量的钠,则两反应各自转移的电子数相同 | |
| D. | 电解熔融氯化钠制钠的电解槽中(如上图),石墨为阳极,铁为阴极 |
| A. | 向10mL 0.1mol•L-1的NaHCO3溶液中滴加3mL0.2mol.L-1盐酸后所得溶液中:c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 20 mL 0.1 mol•L-1 CH3COONa溶液与10 mL 0.1 mol•L-1 HCl溶液混合所得酸性溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中c(CH3COO-)+c(H+)<c(Na+)+c(OH-) | |
| D. | 0.1 mol•L-1( NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| A. | H2+Cl2═2HCl | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | D. | H2+CuO$\frac{\underline{\;高温\;}}{\;}$H2O+Cu |
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |
| A. | 第 IA族元素都是碱金属元素 | |
| B. | 元素原子的最外层电子数等于它的族序数 | |
| C. | 最外层电子数相同的元素不一定在同一个族 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol. 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.