题目内容
10.碳酸盐是重要的化工原料及试剂.(1)向0.02mol/L Na2CO3溶液中加入等体积的CaCl2溶液若开始有沉淀生成,则所需CaCl2溶液的浓度最小为
5.6×10-7mol•L-1(已知25℃时KSP(CaCO3)=2.8×10-9).通过最新工艺可制得纳米(50nm)CaCO3粉末,设计简
单的实验方法证明该物质的产生取少量产品溶于水形成胶体,然后用一束可见光照射,侧面形成一条光亮通路.
(2)已知0.1mol/L NaHCO3溶液的pH=8.某学习兴趣小组探究实验室制得的纯碱含少量NaCl,还可能含少量NaHCO3.为测定纯碱的纯度,用电子天平准确称取样品m克,将其放入锥形瓶中,用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅色变成无色,且半分钟不变色,滴定过程中无气体产生,所用盐酸的体积为V1mL.
①用离子方程式便是此时发生的反应CO32-+H+=HCO3-.
②样品中Na2CO3质量分数的表达式是$\frac{106cV{\;}_{1}×10{\;}^{-3}}{m}$×100%.
③向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL.滴定终点时,溶液颜色的变化是溶液由黄色变为橙色,且半分钟内不变色;若样品中含 NaHCO3,则V1<V2(填“>”、“<”或“=”).
分析 (1)Na2CO3溶液的浓度为0.02mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;根据纳米(50nm)CaCO3粉末溶于水即形成胶体,通过丁达尔现象证明;
(2)①加酚酞指示剂,滴定至溶液由浅色变成无色,则变色范围在碱性,据此书写离子方程式;
②加酚酞指示剂,指示CO32-+H+=HCO3-应的终点,以此来计算碳酸氢钠的质量分数;
③用甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,指示HCO3-+H+=CO2+H2O反应的终点,所用HCl溶液体积为V2 mL,根据V2 和V1的大小来判断.
解答 解:(1)Na2CO3溶液的浓度为0.02mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×0.02mol/L=0.01mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L;
因为纳米(50nm)CaCO3粉末,所以溶于水即形成胶体,则证明该物质的产生的方法为:取少量产品溶于水形成胶体,然后用一束可见光照射,侧面形成一条光亮通路;
故答案为:5.6×10-7mol•L-1;取少量产品溶于水形成胶体,然后用一束可见光照射,侧面形成一条光亮通路;
(2)①加酚酞指示剂,滴定至溶液由浅色变成无色,则变色范围在碱性,所以仅发生反应CO32-+H+=HCO3-;故答案为:CO32-+H+=HCO3-;
②酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由浅色变成无色,指示CO32-+H+=HCO3-反应的终点,所用HCl溶液体积为V1mL,碳酸氢钠的质量为c×V1×10-3×M(Na2CO3)g,碳酸钠的质量分数为$\frac{cV{\;}_{1}×10{\;}^{-3}×106g}{mg}$×100%=$\frac{106cV{\;}_{1}×10{\;}^{-3}}{m}$×100%,故答案为:$\frac{106cV{\;}_{1}×10{\;}^{-3}}{m}$×100%;
③用甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,指示HCO3-+H+=CO2+H2O反应的终点,所用HCl溶液体积为V2 mL,若V2=V1,只有Na2CO3;若V2>V1,则含有NaHCO3,故答案为:溶液由黄色变为橙色;<.
点评 本题主要考查KSP的计算、胶体的检验以及采用滴定法检验纯碱含中NaHCO3的过程,同使也考查了双指示剂法,难度稍大.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案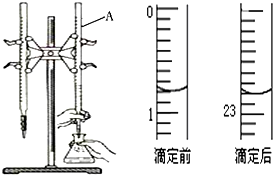 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
(1)配制250mL 0.5mol/L的NaOH溶液所需的玻璃仪器为烧杯、玻璃棒、250ml容量瓶、胶头滴管.
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点.
该同学进行了三次实验,实验数据如表:
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准NaOH溶液前未润洗
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为0.425mol/L(结果保留三位小数).
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 在该条件下充入He气,各物质的反应速率都将增大 | |
| D. | 若反应改为“恒温恒容下”进行,放出Q kJ热量需要的时间将大于2 min |
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
| A. | 28g乙烯与丙烯的混合气体中含有双键数目为NA | |
| B. | 标准状况下,22.4L甘油中含有羟基的数目为3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与S2-数目之和为0.1 NA | |
| D. | 0.2molCl2与0.1molCH4充分反应,生成HCl分子数为0.2 NA |
| A. | 0.8L0.1mol•L-1的KCl溶液 | B. | 0.2L0.2mol•L-1的HCl溶液 | ||
| C. | 0.3L0.2mol•L-1的MgCl2溶液 | D. | 0.5L 0.1mol•L-1的AlCl3溶液 |