题目内容
1.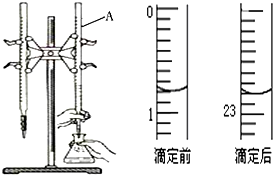 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如表所示.根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度.
正确操作步骤的顺序是BDCEAF(用序号字母填写)
(5)判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色.
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是偏高.
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏低
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
分析 (1)根据仪器的结构来分析;
(2)根据滴定管的结构与精确度为0.01mL;
(3)先根据数据的有效性,然后求出平均消耗V(NaOH),接着根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$来计算;
(4)根据中和滴定有检漏、洗涤、润洗、装液、滴定等操作;
(5)根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(6)根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$来判断不当操作对相关物理量的影响.
解答 解:(1)该滴定管的下端是玻璃活塞,所以仪器的名称为酸式滴定管,
故答案为:酸式滴定管;
(2)滴定前,滴定管中的液面读数为0.80mL,滴定后,滴定管中的液面读数为22.80mL,
故答案为:0.80;22.80;
(3)三次滴定消耗的体积为:22.02mL,22.00mL,21.98mL,数据均有效,则平均消耗V(NaOH)=22.00mL,c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$=$\frac{0.1000mol/L×22.00mL}{20.00mL}$=0.1100mol•L-1,
故答案为:0.1100mol•L-1;
(4)中和滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作,可知正确的操作顺序为:BDCEAF;
故答案为:BDCEAF;
(5)滴定时,当溶液颜色由粉红色变为无色,且半分钟内不变色,可说明达到滴定终点,
故答案为:当溶液颜色由粉红色变为无色,且半分钟内不变色;
(6)①如果上述B步骤省略,即未用标准溶液润洗酸式滴定管2~3次,相当于标准液稀释,导致标准液的体积偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,C(待测)偏高;
故答案为:偏高;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,待测液的物质的量偏小,导致标准液的体积偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,C(待测)偏低;
故答案为:偏低;
③若滴定前锥形瓶未用待测液润洗,待测液的物质的量不变,标准液的体积也不变,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,C(待测)不变;
故答案为:无影响;
④标准液读数时,若滴定前仰视,滴定后俯视,导致标准液的体积偏小,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析,C(待测)偏低;
故答案为:偏低.
点评 本题考查酸碱中和滴定,明确中和滴定实验的仪器、步骤、终点的判定、数据处理等即可解答,注意滴定管的读数为易错点,侧重于考查学生的分析能力和计算能力.

相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
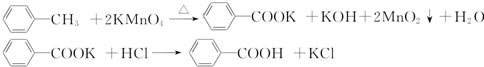
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如图流程分离出苯甲酸和回收未反应的甲苯.
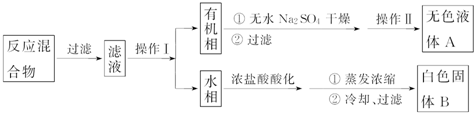
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如表方案进行提纯和检验,实验结果表明推测正确.请在完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
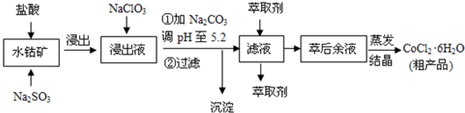
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O
写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
不慎向“浸出液”中加了过量NaClO3,可能会生成有毒气体.写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.加入萃取剂的目的是除去溶液中的Mn2+,防止Co2+转化为Co(OH)2沉淀.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
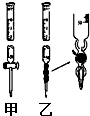 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.①滴定管如图所示,用甲(填“甲”或“乙”)滴定管盛待测定的未知浓度的盐酸.
②用滴定的方法来测定盐酸的浓度,实验数据如下所示:
| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
(2)若用酚酞作指示剂,达到滴定终点的标志是无色变浅红色且30s不变色
(3)以下操作可能造成测定结果偏高的是BC
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
Ⅱ.为了测定某氯化锶(SrCl2)样品的纯度,探究活动小组同学设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO3 2.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2mol•L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.
请回答下列问题:
(1)含Fe3+的溶液作指示剂达到滴定终点时发生颜色变化的离子方程式Fe3++3SCN-?Fe(SCN)3.
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n(Cl-)的测定结果偏高(选填“偏高”“偏低”或“无影响”).
| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
