题目内容
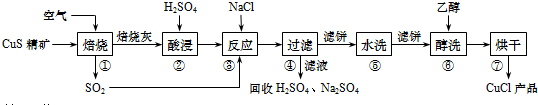
17.用含少量铁的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解.
(1)加热酸溶过程中发生反应的离子方程式有:Fe+2H+→Fe2++H2↑、CuO+2H+→Cu2++H2O
(2)氧化剂A可选用①(填编号,下同)①Cl2②KMnO4③HNO3
(3)要得到较纯的产品,试剂B可选用③①NaOH②FeO ③CuO
(4)试剂B的作用是①③①提高溶液的pH②降低溶液的pH③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是②④①(按实验先后顺序填编号)
①过滤②蒸发浓缩③蒸发至干④冷却
(6)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为ng.
试评价上述两种实验方案,其中正确的方案是二,据此计算得x=$\frac{80m-135n}{18n}$(用含m、n的代数式表示).
分析 向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)铁和氧化铜都与盐酸反应生成盐,根据离子方程式书写规则书写;
(2)①加入的氧化剂和杂质离子反应,和铜离子不反应,且不能引进新的杂质离子;
(3)加入的物质能除去杂质,且不引进新的杂质;
(4)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH;
(5)根据溶液获得晶体的方法分析;
(6)CuCl2•xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,据此来确定x.
解答 解:向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)向固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+→Fe2++H2↑;CuO+2H+→Cu2++H2O,
故答案为:Fe+2H+→Fe2++H2↑、CuO+2H+→Cu2++H2O;
(2)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以A为Cl2,故选①;
(3)得到较纯的产品,试剂可选用CuO或Cu2(OH)2CO3,①②均会引入杂质离子,故选:③;
(4)溶液酸性较强则铁离子不沉淀,为使铁离子沉淀温度则应提高溶液的pH,故选①③;
(5)从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可,故答案为:②④①;
(6)CuCl2•xH2O中x的值的确定依据是加热前后的质量差即为减少的水的质量,所以选择方案二,根据Cu元素守恒,则
CuCl2•xH2O~Cu(OH)2~CuO,
1 1
$\frac{m}{135+18x}$ $\frac{n}{80}$
x=$\frac{80m-135n}{18n}$,
故答案为:二;$\frac{80m-135n}{18n}$.
点评 本题考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、化学计算、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 硫酸镁溶液加氨水:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| B. | 碳酸氢铵溶液加足量氢氧化钠并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| C. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | 3.2g |
| A. | 水合三氯化铝 | B. | 氢氧化铝 | C. | 无水氯化铝 | D. | 氧化铝 |
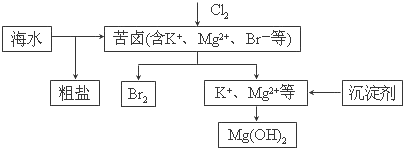
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产中常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其氧化吸收 |
| A. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为1 NA | |
| B. | 78g Na2O2晶体中含有的阴离子数目为2NA | |
| C. | 在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA | |
| D. | pH=13的NaOH溶液中含有的OH-的数目为0.1 NA |
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1.0 mol/(L•s) |