题目内容
9.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料.制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位.含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下: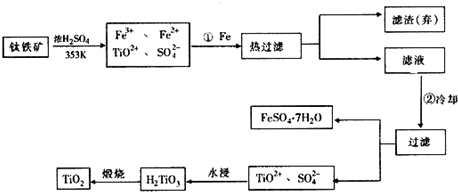
(1)Ti的原子序数为22,Ti位于元素周期表中第四周期,第ⅣB族.
(2)步骤①加铁的目的是将Fe3+还原为Fe2+
步骤②冷却的目的是析出(或分离、或得到)FeSO4•7H2O.
(3)上述制备TiO2的过程中,可以利用的副产物是FeSO4•7H2O;考虑成本和废物综合利用因素,废液中应加入石灰(或碳酸钙、废碱)处理.
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4$→_{300℃,Ar}^{Mg}$Ti
已知:
①C(s)+O2(g)═CO2(g);△H=-393.5KJ•mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-566KJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141KJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g) 的△H=-80kJ•mol-1反应TiCl4+2Mg═2MgCl2+Ti 在Ar气氛中进行的理由是防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
分析 铁粉的作用由步骤①的前后以及最后所得产物中的FeSO4•7H2O分析,不难得出是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4•7H2O可得,是为降低FeSO4•7H2O的溶解度;上述过程中,可以利用的副产物也可从反应产物入手分析为FeSO4•7H2O、CO、MgCl2;Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应;图示水浸过程生成H2TiO3同时生成的H2SO4溶液(TiOSO4+2H2O=H2TiO3+H2SO4),应加入碱性物质处理,依盖斯定律,根据已知①,②可推算出2C(s)+O2(g)=2CO(g)的△H=2×(-393.5)+566=-221 kJ•mol-1,由此结合③可推算出△H=-221+141=-80 kJ•mol-1,据此答题.
解答 解:(1)Ti位于元素周期表中第四周期ⅣB族,
故答案为:四;ⅣB;
(2)铁粉的作用是为了除去混合溶液中的Fe3+;步骤②冷却的目的由操作过滤和得到的物质是FeSO4•7H2O可得,是为降低FeSO4•7H2O的溶解度,
故答案为:将Fe3+还原为Fe2+;析出(或分离、或得到)FeSO4•7H2O;
(3)得到的副产物为FeSO4•7H2O,图示水浸过程生成H2TiO3同时生成的H2SO4溶液(TiOSO4+2H2O=H2TiO3+H2SO4),应加入碱性物质处理,可以是石灰(或碳酸钙、废碱),
故答案为:FeSO4•7H2O; 石灰(或碳酸钙、废碱);
(4)依盖斯定律,将③+①×2-②可得:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g),
△H=(+141kJ•mol-1)+2×(-393.5kJ•mol-1)-(-566kJ•mol-1)=-80 kJ•mol-1,Mg是活泼金属,能与空气中多种物质反应,因此可得出Ar气作用为保护气,防止Mg和空气中物质反应,
故答案为:-80 kJ•mol-1; 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用.
点评 本题考查学生对工艺流程理解、阅读题目获取信息能力、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.

 阅读快车系列答案
阅读快车系列答案| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为-241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| A. | 同温同压下,相同体积的物质,它们物质的量必相等 | |
| B. | 在任何情况下,等质量的氮气和一氧化碳所含分子数必相等 | |
| C. | 1L一氧化碳气体的质量一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中,所含的H+数目一定相等 |
| A. | 浓H2SO4的吸水性和酸性 | |
| B. | 浓H2SO4的脱水性和吸水性 | |
| C. | 浓H2SO4的强氧化性和吸水性 | |
| D. | 浓H2SO4的吸水性和稀H2SO4的通性(酸性) |


