题目内容
7.在A(g)+B(g)?C(g)+D(g)反应中,表示该反应速率最快的是( )| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1.0 mol/(L•s) |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,注意保持单位一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的速率越快,对应反应:2A+B?3C+4D,
A.$\frac{v(A)}{1}$=0.5 mol/(L•s);
B.$\frac{v(B)}{1}$=0.3 mol/(L•s);
C.$\frac{v(C)}{1}$=0.8mol/(L.s),
D.$\frac{v(D)}{1}$=1.0 mol/(L•s),
故D表示的反应速率最快,
故选D.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,也可以转化为同一物质表示的速率进行比较,注意单位保持一致.

练习册系列答案
相关题目
18.储存浓H2SO4的铁罐外口常会出现严重的腐蚀现象,这体现了( )
| A. | 浓H2SO4的吸水性和酸性 | |
| B. | 浓H2SO4的脱水性和吸水性 | |
| C. | 浓H2SO4的强氧化性和吸水性 | |
| D. | 浓H2SO4的吸水性和稀H2SO4的通性(酸性) |
15.下列叙述中,正确的是( )
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
2.在通风橱中进行的下列实验:
下列说法中不正确的是( )
| 步骤 | 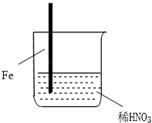 | 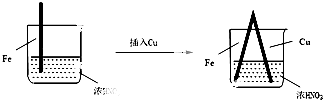 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
12.下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第8项的分子式应为C80H162.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
16.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、S2- |
17.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{4.0×74.5}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
