题目内容
8.有CuO和Fe2O3组成的混合物ag,向其中加入2mol/L的硫酸50mL,恰好完全反应.如将2ag该混合物在足量H2中加热,使其充分反应,冷却后剩余固体的质量为( )| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | 3.2g |
分析 CuO和Fe2O3的混合物与硝酸反应生成硫酸盐和水,CuO~CuSO4,Fe2O3~Fe2(SO4)3,由电荷守恒可知:n混合物(O)=n(SO42-),据此计算2ag混合物中氧元素的质量,用足量CO还原2a g混合物,反应剩余固体为Cu、Fe,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:CuO和Fe2O3的混合物与硝酸反应生成硫酸盐和水,CuO~CuSO4,Fe2O3~Fe2(SO4)3,由电荷守恒,可知ag混合物中n混合物(O)=n(SO42-)=0.05 L×2 mol/L=0.1 mol,故2ag混合物中氧元素的质量为0.1mol×2×16g/mol=3.2g,用足量CO还原2a g混合物,反应剩余固体为Cu、Fe,则金属质量为氧化物的质量减去氧的质量,即金属质量为:2ag-3.2g=2(a-1.6)g,
故选:B.
点评 本题考查混合物的计算,难度中等,确定金属氧化物中O氧原子物质的量与硫酸根的物质的量关系是解答该题的关键,也可以根据酸与氧化物生成水计算氧元素质量.

练习册系列答案
相关题目
7.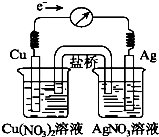 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
8.分子式为C8H10的芳香烃苯环上的一个氢原子被氯原子取代,其生成物有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
16.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 | |
| C. | 向氯水中加入NaHCO3 (固体)可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1 HF溶液加水稀释,其电离平衡常数和 c(H+)/c(HF)均不变 |
3.下列离子方程式正确的是( )
| A. | 盐酸与氨水的反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯气通入FeCl3溶液中:Cl2+Fe2+═Fe3++2Cl- |
13.下列说法中,正确的是( )
| A. | 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红 | |
| B. | 向KI溶液中通入适量Cl2后,溶液颜色变深 | |
| C. | 溴水与NaCl溶液混合时,会发生置换反应 | |
| D. | NaCl溶液在空气中会被氧化,故需要密封保存 |
18.储存浓H2SO4的铁罐外口常会出现严重的腐蚀现象,这体现了( )
| A. | 浓H2SO4的吸水性和酸性 | |
| B. | 浓H2SO4的脱水性和吸水性 | |
| C. | 浓H2SO4的强氧化性和吸水性 | |
| D. | 浓H2SO4的吸水性和稀H2SO4的通性(酸性) |


