题目内容
12.将氯化铝溶液加热蒸干、灼烧,最后所得固体的主要成分是( )| A. | 水合三氯化铝 | B. | 氢氧化铝 | C. | 无水氯化铝 | D. | 氧化铝 |
分析 强酸弱碱盐水解显酸性,水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物.
解答 解:AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,故选D.
点评 本题考查盐类水解的应用,题目难度不大,注意盐类水解的原理及温度对水解平衡的影响.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
3.下列离子方程式正确的是( )
| A. | 盐酸与氨水的反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯气通入FeCl3溶液中:Cl2+Fe2+═Fe3++2Cl- |
7.下列物质是纯净物的是( )
| A. | 新制氯水 | B. | 液氯 | C. | 漂白粉 | D. | 盐酸 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为-241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
1.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们物质的量必相等 | |
| B. | 在任何情况下,等质量的氮气和一氧化碳所含分子数必相等 | |
| C. | 1L一氧化碳气体的质量一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中,所含的H+数目一定相等 |
2.在通风橱中进行的下列实验:
下列说法中不正确的是( )
| 步骤 | 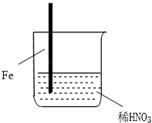 | 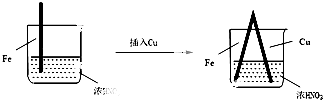 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
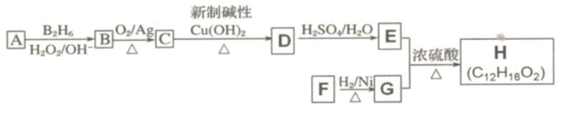
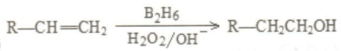
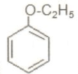 是同分异构体
是同分异构体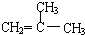 .
.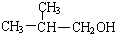 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2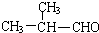 +2H2O.
+2H2O.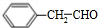 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.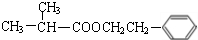 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$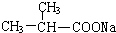 +
+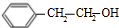 .
.

