题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA
B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA
C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA
D
【解析】
试题分析:A、常温条件下,11.2L甲烷气体的物质的量不是0.5mol,则分子含甲烷分子数不是0.5NA,A错误;B、标准状况下,22.4L Cl2的物质的量是1mol,通入水中生成次氯酸和盐酸,但该反应是可逆反应,因此反应过程中转移电子数小于NA,B错误;C、常温条件下,不能确定0.1mol·L-1的氢氧化钠溶液的体积,则其中含钠离子数不一定为0.1NA,C错误;D、氧气和臭氧都是由氧原子形成的不同单质,所以标准状况下,16g O2和O3的混合气体中氧原子的物质的量是16g÷16g/mol=1mol,因此含氧原子数为NA,D正确,答案选D。
考点:考查阿伏伽德罗常数的计算

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案下列叙述I和II均正确并有因果关系的是
选项 | 叙述I | 叙述II |
A | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
B | 盐酸的酸性强于氢硫酸 | 氯元素比硫元素非金属性强 |
C | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
(16分)采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为 。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、 。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5 mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如下图所示。
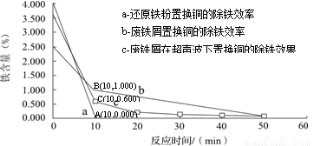
你认为除铁效果最好的是 (填“a”、“b”或“c”),其原因是 。
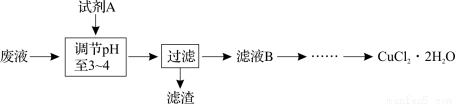
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.3 | 7.5 | 4.7 |
完全沉淀 | 4.1 | 9.7 | 6.7 |
试剂A最好应选用 (填写字母代号),理由是 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液

 296kJ·mol
296kJ·mol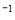 。
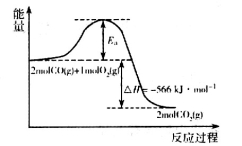
。
 (未配平)。
(未配平)。

