题目内容
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
C
【解析】
试题分析:A硅酸钠是强碱弱酸盐,在溶液中水解是溶液显碱性,所以向硅酸钠溶液中滴加1滴酚酞溶液变为红色,然后逐滴加入稀盐酸,由于硅酸钠不断发生反应产生NaCl,溶液的碱性逐渐减弱,所以红色逐渐褪去,可以证明酸性盐酸>硅酸,正确;B.在在酒精灯上加热铝箔,金属与O2在加热时发生反应产生Al2O3,由于Al2O3的熔点是2050℃,高于Al的熔点660℃,所以铝箔熔化但不滴落,正确;C.在常温下,向浓硫酸中投入铁片,由于浓硫酸有强氧化性,会把Fe氧化产生一层致密的氧化物保护膜而阻止了金属的进一步反应,即发生钝化现象,因此铁片不溶解,不明说常温下,铁不与浓硫酸反应,错误;D.向某溶液中先滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色,是因为发生反应:2Fe2++Cl2=2Fe3++2Cl-, Fe3+与SCN-发生络合反应形成络离子,是溶液显红色,可以证明溶液中含有Fe2+,没有Fe3+,正确。
考点:考查实验操作和现象与结论关系的正误判断的知识。

(16分)采用32%~35%的FeCl3溶液腐蚀印刷线路板上的金属铜,腐蚀废液中主要含有CuCl2、FeCl2和HCl等溶质。
(1)用FeCl3溶液溶解印刷线路板上金属铜的化学方程式为 。
(2)工业上用铁粉回收腐蚀废液中的铜,方法如下:
①用铁粉回收铜的操作为:加入过量铁粉,充分搅拌,过滤、洗涤、 。
②科学家对铁置换铜的工艺有如下研究:
分别在a、b、c三种条件下回收腐蚀废液中的铜,取充分反应后的粉末各3.000 g分别放入甲、乙、丙三个烧杯中,再加入100 mL 0.5 mol·L-1的硫酸,水浴加热(70 ℃),搅拌,进行除铁处理。分别在第10、20、30、40、50 min时,用吸管移取0.5 g左右的铜试样于试管内,测定铜粉中铁的含量(质量分数),其结果如下图所示。
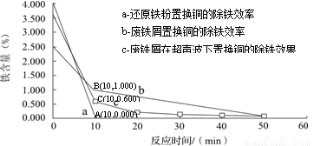
你认为除铁效果最好的是 (填“a”、“b”或“c”),其原因是 。
(3)工业上可用腐蚀废液制备CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
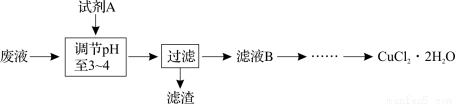
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀 | 2.3 | 7.5 | 4.7 |
完全沉淀 | 4.1 | 9.7 | 6.7 |
试剂A最好应选用 (填写字母代号),理由是 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
 NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 296kJ·mol
296kJ·mol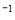 。
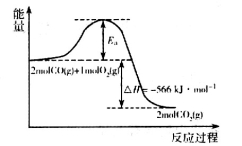
。
 (未配平)。
(未配平)。
