题目内容
2.某地-辆装载砒霜的货牢因故滑入河道,部分砒霜散落到河中.砒霜的主要成分是${{A}_{{s}_{2}}O}_{3}$,有剧毒,致死量为0.1g,可用于制造杀虫剂和灭鼠剂等.${{A}_{{s}_{2}}O}_{3}$是两性偏酸性氧化物.其无色晶体在193°C时升华,微溶于水生成H3AsO3;其对应的盐均有毒,其中碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水.(1)${{A}_{{S}_{2}}O}_{3}$属于共价(填“离子“或“共价“)化合物,H3AsO3属于共价(填“离子“或“共价“)化合物,含有共价键.
(2)向该河水中加生石灰(填“生石灰”,“NaOH”)可减轻砷对河水的污染.
分析 (1)只存在As、O之间的化学键,H3AsO3为酸,含As、O之间和O、H之间的共价键;
(2)由碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水可知,加CaO发生酸碱中和反应可降低毒性.
解答 解:(1)砒霜中只存在As、O之间的共价键,为共价化合物,H3AsO3为酸,含As、O之间和O、H之间的共价键,为共价化合物,
故答案为:共价;共价;共价;
(2)由碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水可知,加CaO发生酸碱中和反应可降低毒性,则向该河水中加生石灰可减轻砷对河水的污染,
故答案为:生石灰.
点评 本题考查化学键及应用,为高考常见题型,侧重于学生的分析能力和应用能力的考查,注意把握习题中的信息及化学键判断的一般规律为解答的关键,题目难度中等.

练习册系列答案
相关题目
12.醋酸是电解质,下列事实能说明醋酸是弱电解质组合的是( )
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥0.1mol•L-1醋酸钠溶液的pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,醋酸产生H2的速率慢
⑧0.1mol•L-1醋酸溶液能使紫色石蕊试液变红.
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥0.1mol•L-1醋酸钠溶液的pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,醋酸产生H2的速率慢
⑧0.1mol•L-1醋酸溶液能使紫色石蕊试液变红.
| A. | ②⑥⑦⑧ | B. | ③④⑤⑥ | C. | ③④⑥⑦ | D. | ①②⑧ |
13.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y和W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Z、W均可形成含Y元素的离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X>W |
17.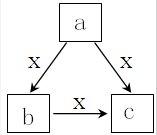 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )| A. | 若a、b、c焰色反应均呈黄色,其水溶液均为碱性,则a中可能既含有离子键又含有共价键 | |
| B. | 若X为O2,a为一种固态单质,则c可能为CO2或SO2 | |
| C. | 若b为固态非金属单质,X为气体单质,且b与X所含元素同主族,则a→b、b→c、a→c的反应均为氧化还原反应 | |
| D. | 若a、b、c均含有同一种非金属,且X的水溶液呈碱性,则c可能受热易分解 |
7.某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,则该卤代烷的结构有( )
| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.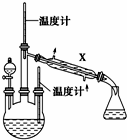 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl