题目内容
5.(1)NaHCO3是一种强(填“强”或“弱”)电解质;(2)写出HCO3-水解的离子方程式:HCO3-+H2O H2CO3+OH- ;
(3)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五种微粒的浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
(4)常温下,相同浓度的Na2CO3溶液和NaHCO3溶液碱性较强的是Na2CO3 溶液,
Na2CO3溶液中表示电荷守恒的式子为c(Na+)+ c(H+)═2c(CO32-) + c(HCO3-)+c(OH-).
分析 (1)在水溶液中能够完全电离的电解质为强电解质;
(2)碳酸氢根离子为多元弱酸的酸式根离子,部分水解生成碳酸和氢氧根离子;
(3)0.1mol•L-1NaHCO3溶液的pH大于8,说明碳酸氢根离子的水解程度大于电离程度;
(4)CO32-为多元弱酸根离子,分步水解,以第一步水解为主,第二步水解程度远远小于第一步;
根据Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-; CO32-+H2O?HCO3-+OH-; HCO3-+H2O?H2CO3+OH-; H2O?H++OH-结合根据溶液呈电中性来分析;
解答 解:(1)碳酸氢钠在水溶液中能够完全电离,为强电解质;
故答案为:强;
(2)碳酸氢根离子为多元弱酸的酸式根离子,部分水解生成碳酸和氢氧根离子,离子方程式:HCO3-+H2O H2CO3+OH-;
故答案为:HCO3-+H2O H2CO3+OH-;
(3)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-).
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);
(4)CO32-为多元弱酸根离子,分步水解,以第一步水解为主,第二步水解程度远远小于第一步,所以相同浓度的Na2CO3溶液和NaHCO3溶液碱性较强的是Na2CO3 溶液;
Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-; CO32-+H2O?HCO3-+OH-; HCO3-+H2O?H2CO3+OH-; H2O?H++OH-,溶液中存在离子为:Na+、HCO3-、CO32-、H+、OH-,溶液呈电中性可知:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),
故答案为:Na2CO3 ;c(Na+)+ c(H+)═2c(CO32-)+c(HCO3-)+c(OH-)
点评 本题考查了电解质强弱判断、盐类水解方程式书写、离子浓度大小比较、盐溶液中电荷守恒书写,明确电解质性质、盐类水解规律是解题关键,题目难度中等.

| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向AgNO3溶液中加入过量氨水 | 由白色沉淀生成 | Ag+与NH3•H2O不能共存 |
| B | 向2ml2%的CuSO4溶液中加入0.5mol/L的NaOH溶液,震荡后低价几滴M溶液,加热 | 未出现砖红的沉淀 | M不属于醛类物质 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 由白色沉淀生成 | 验证两者都发生了水解反应,且相互促进 |
| D | 向草酸溶液中低价几滴紫色酸性KmnO4溶液,震荡 | 溶液紫色褪去 | 草酸具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
| A. | 用钥匙取用少量二氧化锰粉末 | |
| B. | 向燃着的酒精灯中直接添加酒精 | |
| C. | 实验室加热高猛酸钾制氧气的装置制取氨气 | |
| D. | 实验室将少量金属钠保存在煤油中 |
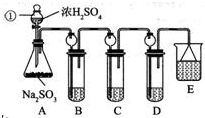
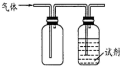 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 酸性高锰酸钾溶液 | 溶液褪色 | X一定SO2 |
| B | NH3 | 酚酞试液 | 溶液变为红色 | 氨水呈碱性 |
| C | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
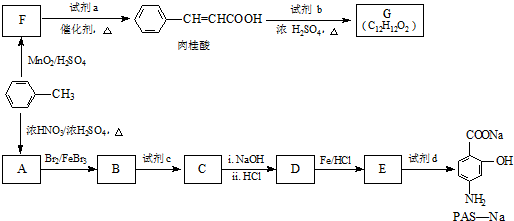
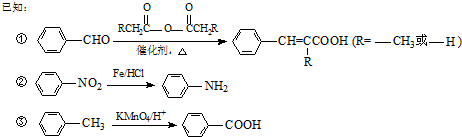
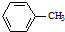 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.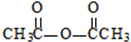 .
.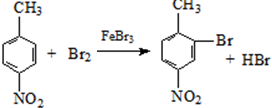 .
.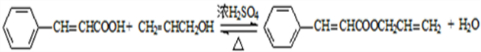 .
. .
. 四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题:
四种短周期主族元素A、B、C、D均属于非金属元素,它们在周期表中的位置如图所示.请回答列问题: