题目内容
7.某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,则该卤代烷的结构有( )| A. | 一种 | B. | 二种 | C. | 三种 | D. | 四种 |
分析 某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,碳碳双键是由卤原子和连接卤原子碳原子相邻碳原子上H原子发生消去反应生成的,据此判断卤代烷结构种类.
解答 解:某烯烃CH3CH=C(CH3)2是卤代烷消去而生成,碳碳双键是由卤原子和连接卤原子碳原子相邻碳原子上H原子发生消去反应生成的,该卤代烃的结构简式为CH3CHClC(CH3)2或CH3CH2Cl(CH3)2两种结构,故选B.
点评 本题以同分异构体种类判断为载体考查有机物结构和性质,为高频考点,明确卤代烃发生消去反应结构特点是解本题关键,能发生消去反应的卤代烃中连接卤原子碳原子相邻碳原子上必须含有H原子,否则不能发生消去反应,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.在复杂的体系中,确认化学反应先后顺序有利于解决问题.下列化学反应先后顺序判断正确的是( )
| A. | 在含等物质的量的AlO2-、OH-、SO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、SO32- | |
| B. | 在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入SO2:KOH、Ba(OH)2、BaSO3 | |
| D. | 在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
15.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用.下列有关这两种液体的实验描述都正确的是( )
| A. | 两种液体都可以使干燥的布条褪色 | |
| B. | 两种液体都可以使干燥的蓝色石蕊试纸变红 | |
| C. | 用这两种液体都可给自来水消毒 | |
| D. | 分别向这两种液体中投人几颗金属锌粒均有气泡产生 |
3.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2
I2+2S2O32-═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
7.关于溶液的酸碱性说法正确的是( )
| A. | [H+]很小的溶液一定呈碱性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | [OH-]=[H+]的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
8.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
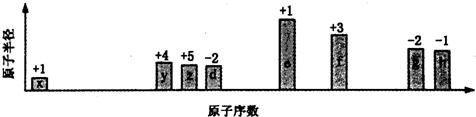

| A. | 离子半径的大小顺序:e>f>g>h | |
| B. | 与x形成简单化合物的沸点:y>z>d | |
| C. | x、z、d三种元素形成的化合物可能含有离子键 | |
| D. | e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 |
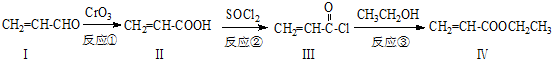
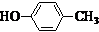 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为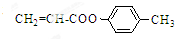 .
.