题目内容
3.11.2gFe与足量稀硫酸混合,充分反应,消耗多少克H2SO4?生成FeSO4的物质的量为多少?分析 欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出硫酸的物质的量和硫酸亚铁的质量,由此分析解答.
解答 解:设反应消耗x 克H2SO4,硫酸亚铁的物质的量为y
Fe+H2SO4 =FeSO4 +H2↑
56 98 1
11.2g x y
$\frac{56}{11.2}=\frac{98}{x}=\frac{1}{y}$
解之得:
x=19.6g;y=0.2mol
答:消耗19.6g的H2SO4,生成FeSO4的物质的量为0.2mol.
点评 本题是根据化学方程式的计算题,我们计算的依据是化学方程式,所以务必要保证我们的出发点即化学方程式要书写正确,然后再根据相关物质的量之比进行求算.

练习册系列答案
相关题目
14.下列实验操作或方法中,不合理的是( )
| A. | 用钥匙取用少量二氧化锰粉末 | |
| B. | 向燃着的酒精灯中直接添加酒精 | |
| C. | 实验室加热高猛酸钾制氧气的装置制取氨气 | |
| D. | 实验室将少量金属钠保存在煤油中 |
11.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,11.2 L氧气含有的原子数目为NA | |
| B. | 锌从盐酸中置换出1 mol H2,转移的电子数目为NA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 NA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2NA |
18.肉桂酸甲酯(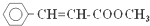 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
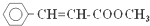 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )| A. | 能与溴的四氯化碳溶液发生加成反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 在碱性条件下能发生水解反应 | |
| D. | 不可能发生加聚反应 |
8.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
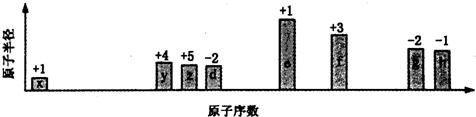

| A. | 离子半径的大小顺序:e>f>g>h | |
| B. | 与x形成简单化合物的沸点:y>z>d | |
| C. | x、z、d三种元素形成的化合物可能含有离子键 | |
| D. | e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应 |
15.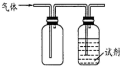 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
( )
 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 酸性高锰酸钾溶液 | 溶液褪色 | X一定SO2 |
| B | NH3 | 酚酞试液 | 溶液变为红色 | 氨水呈碱性 |
| C | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
12.能正确表示下列反应的离子方程式是( )
| A. | NH4HCO3溶液中加入足量NaOH溶液共热:NH+4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | 用食醋溶解水垢:CaCO3+2H+═Ca2++CO2↑+H2O Mg(OH)2+2H+═Mg2++2H2O |