题目内容
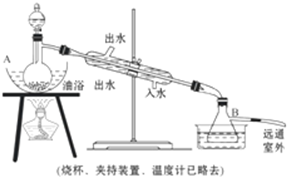
16.化学兴趣小组的同学设计实验探究浓硫酸与木炭反应后产生气体的成分.(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:
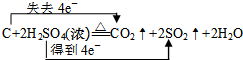 .
.【装置设计】组装如下的实验装置,然后进行实验探究.
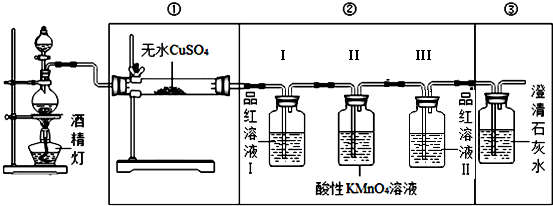
(2)装入反应物之前,必须先检验装置气密性.
【实验探究】
(3)观察实验,完成实验现象的部分记录:
| 实验装置 | ① | ③ |
| 实验现象 |
分析 C与浓硫酸反应生成二氧化碳、二氧化硫和水,要探究浓硫酸与木炭反应后产生气体的成分,应首先验证水,利用无水硫酸铜验证即可,若无水硫酸铜变蓝,则证明有水生成,要验证二氧化碳,必须排除二氧化硫的干扰,故接着应利用二氧化硫可以使品红溶液褪色的特征验证二氧化硫,验证二氧化碳需要除净二氧化硫,可以采用高锰酸钾吸收,过后再次利用品红溶液验证二氧化硫是否除净,据此解答各小题即可.
解答 解:(1)C与浓硫酸反应生成二氧化碳、二氧化硫和水,此过程中C元素化合价由0价升高到+4价、S元素化合价由+6价降低到+4价,故电子转移与方向为: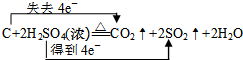 ;
;
故答案为: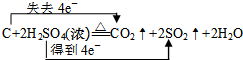 ;
;
(2)装入试剂前,应首先检验装置的气密性;
故答案为:检验装置气密性;
(3)由于C与浓硫酸反应生成水,故①中无水CuSO4变为蓝色; ③若石灰水变浑浊,说明含有二氧化碳;
故答案为:①无水CuSO4变为蓝色; ③石灰水变浑浊;
(4)依据分析可知,②中品红溶液Ⅰ的作用验证是否生成二氧化硫,Ⅲ的作用验证二氧化硫是否被除尽,
故答案为:验证烧瓶中有SO2;确认SO2除尽.
点评 本题考查了探究C与浓硫酸的反应、氧化还原反应,题目难度不大,注意从化合价的角度分析氧化还原反应,明确反应原理、以及二氧化硫和二氧化碳的检验方法是解题的关键.

练习册系列答案
相关题目
1. 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)Q<0(填“>”、“=”或“<”).
(2)可以判断该反应达到化学平衡状态的叙述是CD(填字母).
A.单位时间内减少 CO(g) 的浓度等于生成 CO2(g) 的浓度
B.反应容器内的压强不发生变化
C.混合气体中 H2(g) 的浓度不再发生改变
D.氢气的生成速率等于水的生成速率
(3)若在850℃时向反应容器中充入H2O(g),K值不变(填“增大”、“减小”或“不变”).
(4)表中c2为0.18mol/L.
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
(1)Q<0(填“>”、“=”或“<”).
(2)可以判断该反应达到化学平衡状态的叙述是CD(填字母).
A.单位时间内减少 CO(g) 的浓度等于生成 CO2(g) 的浓度
B.反应容器内的压强不发生变化
C.混合气体中 H2(g) 的浓度不再发生改变
D.氢气的生成速率等于水的生成速率
(3)若在850℃时向反应容器中充入H2O(g),K值不变(填“增大”、“减小”或“不变”).
(4)表中c2为0.18mol/L.
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).