题目内容
1.根据周期表对角线规则,金属Be与A1单质及其化合物性质相似,试回答下列问题:(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式Be+2OH-=BeO22-+H2↑;
(2)Be(OH)2与Mg(OH)2 可用NaOH溶液试剂鉴别,其反应离子方程式为Be(OH)2+2OH-=BeO22-+2H2O.
分析 (1)元素周期表中,处于对角线位置的元素具有相似的性质,则根据铝的单质的性质可推断铍与氢氧化钠的反应;
(2)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应.
解答 解:(1)金属铍与铝的单质及其化合物性质相似,则Be与NaOH溶液反应生成Na2BeO2和氢气,离子反应为Be+2OH-=BeO22-+H2↑,
故答案为:Be+2OH-=BeO22-+H2↑;
(2)氢氧化铍与氢氧化铝性质相似,能和氢氧化钠反应,而Mg(OH)2和氢氧化钠不反应,则选NaOH溶液鉴别,离子反应为Be(OH)2+2OH-=BeO22-+2H2O,
故答案为:NaOH溶液;Be(OH)2+2OH-=BeO22-+2H2O.
点评 本题考查元素周期表及应用,为高频考点,侧重学生分析能力及知识迁移应用能力的考查,注意利用已知物质的性质进行类别解答,注意物质的相似之处和不同之处,难度不大.

练习册系列答案
相关题目
11.两种气态烃的混合物共0.1mol,完全燃烧后得3.36LCO2 (标准状况下)和3.6gH2O.下列说法不正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | ||
| C. | 一定没有乙烷 | D. | 可能是甲烷和乙烯的混合物 |
9.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子数是最内层电子数的2倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子形成的-2价简单阴离子的核外电子排布与K+相同.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Y元素最高价氧化物的晶体具有很高的熔点和沸点 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | W元素的氧化物对应水化物均为强酸 |
16.下列变化中,吸收的热量用于克服分子间作用力的是( )
| A. | 加热氯化钠晶体使之熔化 | B. | 加热碘化氢气体使之分解 | ||
| C. | 加热硅晶体使之熔化 | D. | 液氨受热蒸发 |
13.下列关于离子共存的说法正确的是( )
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | pH=2的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | 含AlO2-的溶液中:Na+、K+、NO3-、Al3+ | |
| D. | 含大量Fe3+的溶液中:K+、Na+、NO3-、H+ |
10.将下列物质的溶液在蒸发皿中加热蒸干并灼烧,可得到该物质的固体的是( )
| A. | MgCl2 | B. | NH4Cl | C. | Na2CO3 | D. | KMnO4 |

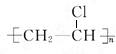 ,该反应类型是加聚反应
,该反应类型是加聚反应 取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.
取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.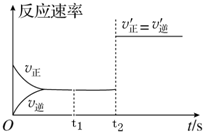 在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).
在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).