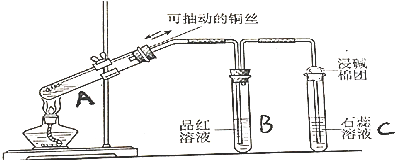
题目内容
6.X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收.已知X是化石燃料燃烧的产物之一,有漂白作用,是形成酸雨的主要物质;Y是一种黄绿色的单质气体,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,是一种红棕色气体,能与水反应.请按要求回答下列问题:(1)检验X气体通常将其通入品红溶液中,现象为品红溶液红色褪去.
(2)实验室通常用NaOH溶液吸收多余的Y气体,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(3)Z与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
分析 X是化石燃料燃烧的产物之一,有漂白作用,是形成酸雨的主要物质,则X为SO2;Y是一种黄绿色的单质气体,其水溶液具有漂白性,Y为Cl2,生成的HClO具有漂白性;Z是硝酸工业和汽车尾气的有害物质之一,易溶于水,则Z为NO2,然后结合物质的性质及化学用语来解答.
解答 解:X是化石燃料燃烧的产物之一,有漂白作用,是形成酸雨的主要物质,则X为SO2;Y是一种黄绿色的单质气体,其水溶液具有漂白性,Y为Cl2,生成的HClO具有漂白性;Z是硝酸工业和汽车尾气的有害物质之一,易溶于水,则Z为NO2,
(1)X为SO2,检验二氧化硫一般把气体通入品红溶液,品红溶液褪色,
故答案为:品红;品红溶液红色褪去;
(2)氯气有毒,实验时要用碱液吸收多余的气体,一般用氢氧化钠溶液,其反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)Z溶于水的反应为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO.
点评 本题考查无机物的推断,把握习题中的信息、物质的性质推断物质为解答的关键,注意酸雨、漂白性、物质类别等为推断的突破口,侧重N、Cl及其化合物性质的考查,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
16.下列说法错误的是( )
| A. | 热化学方程式:H2(g)+F2(g)=2HF(g)△H=-270 kJ,表示的意义为2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 | |
| B. | 用pH试纸测定1 mol/L的醋酸溶液,显示的pH为2~3能证明醋酸为弱电解质 | |
| C. | 为减少洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | pH计是精确测定溶液pH的仪器 |
17.下列关于有机物的说法不正确的是( )
| A. | 可用水来鉴别苯和CCl4 | |
| B. | 煤的干馏属于化学变化,硝化反应、酯化反应、皂化反应都属于取代反应 | |
| C. | CH2Cl2有两种同分异构体 | |
| D. | 高温加热能杀死病毒是因为构成病毒的蛋白质受热变性 |
14.下列变化不能用勒夏特列原理解释的是( )
| A. | 实验室中常用饱和食盐水除去Cl2中混有的HCl | |
| B. | 银器长期放置,表面变暗 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | 氨水中加酸,NH4+的浓度增大 |
1.下列叙述正确的是( )
| A. | SO2和SO3都是酸性氧性物,二者的水溶液都是强酸 | |
| B. | 将足量的SO2通入BaCl2溶液中可生成白色沉淀 | |
| C. | 检验SO2中是否含有CO2的方法是通过澄清的石灰水 | |
| D. | 向含有BaCl2和NaOH的混合溶液中通入少量SO2气体,有白色沉淀生成 |
11.下列实验方案中,不能 达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 验证盐类的水解是否是吸热反应 | 向醋酸钠溶液中滴入酚酞试液,加热观察红色是否加深 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
18.屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,救了数千万人的生命,青蒿素分子结构如图.下列有关说法正确的是( )

| A. | 青蒿素可溶于乙醚和水 | |
| B. | 青蒿素的晶体为分子晶体,化学式为C16H20O5 | |
| C. | 青蒿素与NaOH溶液不反应 | |
| D. | 青蒿素含有过氧键,一定条件下有氧化性 |
15.下列化学用语正确的是( )
| A. | 氯化氢的比例模型: | B. | Cl-的结构示意图: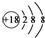 | ||
| C. | 氯乙烯的结构简式:CH2=CHCl | D. | HClO的电子式: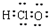 |