题目内容
1.下列叙述正确的是( )| A. | SO2和SO3都是酸性氧性物,二者的水溶液都是强酸 | |
| B. | 将足量的SO2通入BaCl2溶液中可生成白色沉淀 | |
| C. | 检验SO2中是否含有CO2的方法是通过澄清的石灰水 | |
| D. | 向含有BaCl2和NaOH的混合溶液中通入少量SO2气体,有白色沉淀生成 |
分析 A、SO2和SO3都是酸性氧性物,二氧化硫对应的酸是亚硫酸弱酸;
B、弱酸不能制强酸;
C、二氧化硫和二氧化碳都能使澄清石灰水变浑浊;
D、二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡生成亚硫酸钡.
解答 解:A、SO2和SO3都是酸性氧性物,二氧化硫对应的酸是亚硫酸弱酸,而不是都是强酸,故A错误;
B、弱酸不能制强酸,二氧化硫与氯化钡不反应,故B错误;
C、二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以不能用SO2中是否含有CO2的方法是通过澄清的石灰水,故C错误;
D、二氧化硫与氢氧化钠反应生成亚硫酸钠,亚硫酸钠与氯化钡生成亚硫酸钡,所以观察有白色沉淀生成,故D正确;
故选D.
点评 本题考查二氧化硫的化学性质,涉及物质的鉴别和转化,题目难度中等,本题注意把握常见物质的性质,根据性质的异同选择实验方案.

练习册系列答案
相关题目
11.对于化学反应的限度的叙述不正确的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g)只有达到限度时才有2v(O2)=v(SO3) | |
| C. | 对于反应2SO2(g)+O2(g)?2SO3(g)达到限度时,增大容器容积能减小正反应速率 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
12. 2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )
2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )
 2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )
2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K).下列说法不正确的是( )| A. | 该过程可以表示为:CO+O$\frac{\underline{\;催化剂\;}}{\;}$C02 | |
| B. | 该过程中有热量放出 | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 钌催化剂能改变该反应的焓变 |
16.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应为吸热反应.(填“吸热”或“放热”)
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”“小”或“不能确定”)
(3)1000℃时,向该容器中通入CO2和H2进行上述反应,能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变 C.混合气体的密度不变 D.c(CO)=c(CO2)
E.化学平衡常数K不变 F.单位时间内生成CO的分子数与生成H2O的分子数相等.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应.(填“吸热”或“放热”)
(2)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,c(H2O)=0.03mol/L,
c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率小(填“大”“小”或“不能确定”)
(3)1000℃时,向该容器中通入CO2和H2进行上述反应,能说明该反应达平衡状态的是B
A.容器中压强不变 B.混合气体中c(CO)不变 C.混合气体的密度不变 D.c(CO)=c(CO2)
E.化学平衡常数K不变 F.单位时间内生成CO的分子数与生成H2O的分子数相等.
13.反应CO(g)+H2(g)?C(s)+H2O(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )①?将容器的体积缩小一半②?保持体积不变,充入He?③保持压强不变,充入He.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ② |
11.化学中部分物质既能和盐酸反应又能和氢氧化钠溶液反应,下列物质不具有这种性质的是( )
| A. | Al | B. | Al(OH)3 | C. | FeSO4 | D. | NaHCO3 |
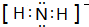 .
.