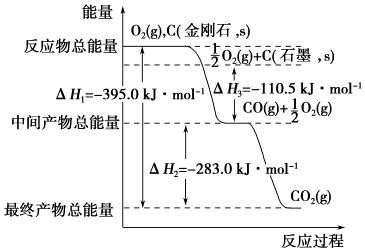
题目内容
14.一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如图: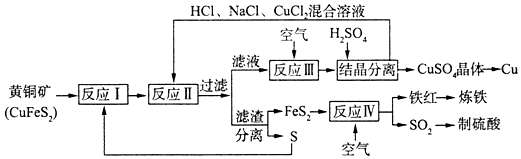
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-═2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为Fe2O3;
(2)“反应Ⅱ”的还原剂是CuS(填化学式);
(3)“反应III”的离子方程式为4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O;
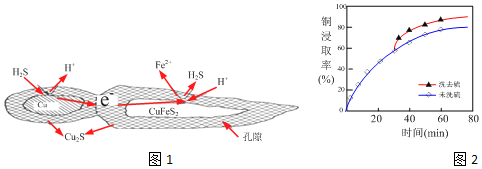
(4)辉铜矿的主要成分是Cu2S,可由黄铜矿(主要成分CuFeS2)通过电化学反应转变而成,有关转化如图1 所示.转化时正极的电极反应式为2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑.
(5)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂.
①反应Cu2S+4FeCl3?2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为2mol或2NA;浸取时,在有氧环境下可维持Fe3+较高浓度.有关反应的离子方程式是4Fe2++O2+4H+=4Fe3++2H2O.
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化如图2,其原因是生成的硫覆盖在Cu2S表面,阻碍浸取.
(6)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq)?Cu2S(s)+2Cl-(aq),该反应的平衡常数K=5.76×1030[已知Ksp(CuCl)=1.2×10-6,Ksp(Cu2S)=2.5×10-43].
分析 黄铜矿与S在高温下煅烧,使其转变为FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl-=2[CuCl2]-+S↓,过滤得到滤液中通入空气发生反应4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,FeS2通入空气灼烧得到氧化铁和二氧化硫,氧化铁炼钢,二氧化硫制备硫酸,
(1)铁红为三氧化二铁;
(2)根据还原剂的定义分析;
(3)反应Ⅲ中生成铜离子;
(4)正极得电子发生还原反应,化合价升高,则正极为CuFeS2生Cu2S、Fe2+、H2S,据此书写;
(5)①根据反应中化合价的升降变化分析;根据亚铁离子易被氧化分析;
②生成的硫覆盖在Cu2S表面,阻碍浸取;
(6)根据化学平衡常数分析;
解答 解:(l) 铁红为三氧化二铁,化学式为:Fe2O3;
故答案为:Fe2O3;
(2)由题:“反应Ⅱ”的离子方程式为Cu2++CuS+4C1-═2[CuCl2]-+S,其中硫元素化合价升高,发生氧化反应,CuS作还原剂;
故答案为:CuS;
(3)反应Ⅲ中生成铜离子,则离子反应为:4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;
故答案为:4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O;
(4)正极得电子发生还原反应,化合价升高,根据图可知,CuFeS2得电子生成Cu2S、Fe2+、H2S,故电极反应式为:2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑;
故答案为:2CuFeS2+6H++2e-=Cu2S+2Fe2++3H2S↑;
(5)①反应Cu2S+4FeCl3?2CuCl2+4FeCl2+S,亚铜离子失去电子生成铜离子,硫离子失去电子生成硫,铁离子得电子生成亚铁离子,生成2mol CuCl2,反应中转移电子的数目为4mol,故生成1mol CuCl2,反应中转移电子的数目为2mol或2NA;其中亚铁离子易被氧化,发生反应:4Fe2++O2+4H+=4Fe3++2H2O,故浸取时,在有氧环境下可维持Fe3+较高浓度;
故答案为:2mol或2NA;4Fe2++O2+4H+=4Fe3++2H2O;
②根据图可知,未洗硫洗去硫的铜的浸取率低,因为生成的硫覆盖在Cu2S表面,阻碍浸取;
故答案为:生成的硫覆盖在Cu2S表面,阻碍浸取;
(6)已知Ksp(CuCl)=1.2×10-6,Ksp(Cu2S)=2.5×10-43,反应为2CuCl(s)+S2-(aq)?Cu2S(s)+2Cl-(aq),平衡常数K=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$=$\frac{{c}^{2}(C{l}^{-})}{c({S}^{2-})}$•$\frac{{c}^{2}(C{u}^{2+})}{{c}^{2}(C{u}^{2+})}$=$\frac{Ksp(CuCl)^{2}}{Ksp(C{u}_{2}S)}$=$\frac{(1.2×1{0}^{-6})^{2}}{2.5×1{0}^{-43}}$=5.76×1030;
故答案为:5.76×1030.
点评 本题以实际化工生产“黄铜矿的综合利用”为背景,考查了元素化合物知识,离子方程式和化学方程式的书写及有关计算,题目更注重考查学生利用化学原理来解决实际问题的能力,利用溶度积计算K,题目难度中等.

| A. | NH4HSO3与NaOH等物质的量反应:NH4++HSO3-+2OH-═NH3•H2O+SO32- | |
| B. | 铜与浓硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 过量SO2通入次氯酸钠溶液:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 2.0 | 0 |
| 2s末浓度(mol/L) | 0.6 | 0.4 | 0.8 |
| A. | 3:1:2 | B. | 3:2:1 | C. | 2:1:3 | D. | 9:3:4 |
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(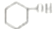 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
| A. | 第ⅦA族从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 同周期,从左到右,元素金属性逐渐减弱,非金属性逐渐增强(稀有气体元素除外) | |
| C. | 因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强 | |
| D. | Cs是最活泼金属元素,F是最活泼非金属元素 |
| A. | “真金不怕火炼”说明有些金属(例如金)即使在高温下也不与氧气发生反应 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 含重金属离子的电镀废液不能随意排放 | |
| D. | 铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| A. | 氢气在在氯气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | CaCO3与稀盐酸反应制取CO2 | D. | CaO溶于水 |