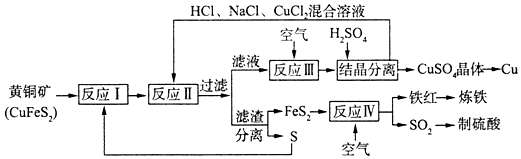
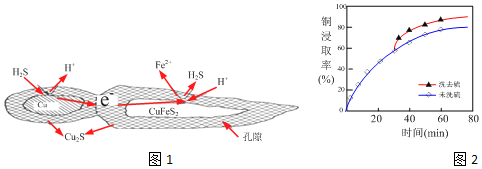
题目内容
5.下列说法正确的是( )| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
分析 A.次氯酸根离子具有强氧化性,能氧化还原性离子;
B.铁离子能氧化碘离子;
C.等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合,溶液中存在物料守恒,根据物料守恒判断;
D.常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,说明CH3COOH电离程度大于CH3COONa水解程度,但醋酸电离程度较小.
解答 解:A.次氯酸根离子具有强氧化性,能氧化还原性离子碘离子,所以这几种微粒不能大量共存,故A错误;
B.铁离子能氧化碘离子,离子方程式为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合,溶液中存在物料守恒,根据物料守恒得2[c(CH3COOH)+c(CH3COO-)]═c(NH4+)+c(NH3•H2O),故C错误;
D.常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则c(H+)>c(OH-),说明CH3COOH电离程度大于CH3COONa水解程度,但醋酸电离程度较小,所以微粒浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较、离子共存等知识点,为高频考点,明确离子共存条件、混合溶液中溶质成分及其性质是解本题关键,注意B中不仅发生中和反应还发生氧化还原反应,往往因为漏掉氧化还原反应而导致错误.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
15.下列各组物质中,化学键类型完全相同的是( )
| A. | HCl、CaCl2 | B. | H2O2、Na2O2 | C. | NaOH、H2O | D. | CO2、CH4 |
13.对于可逆反应2A(g)+3B(g)?3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是( )
| A. | 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3 | |
| B. | 正逆反应速率相等且等于零 | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了amolA物质,则同时也消耗了1.5amolC物质 |
20.氯苯在染料、医药工业中有广泛的应用,某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯.
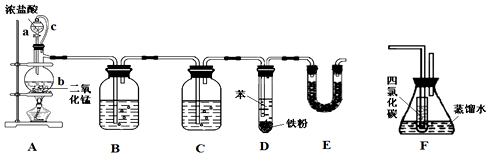
反应物和产物的相关数据列表如下:
请按要求回答下列问题.
(1)装置A中橡胶管c的作用是,装置E的作用是除去氯气和氯化氢气体,防止大气污染.
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是有黄绿色气体生成,写出反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于D和E之间(填字母),F中小试管内CCl4的作用是除去氯气,还需使用的试剂是硝酸酸化的硝酸银溶液.
(4)已知D中加入5mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为47.3%(保留三位有效数字).

反应物和产物的相关数据列表如下:
| 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 苯 | 0.879 | 80.1 | 微溶 |
| 氯苯 | 1.11 | 131.7 | 不溶 |
(1)装置A中橡胶管c的作用是,装置E的作用是除去氯气和氯化氢气体,防止大气污染.
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是有黄绿色气体生成,写出反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于D和E之间(填字母),F中小试管内CCl4的作用是除去氯气,还需使用的试剂是硝酸酸化的硝酸银溶液.
(4)已知D中加入5mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为47.3%(保留三位有效数字).
10.下列说法正确的是( )
| A. | NaOH溶液的导电能力一定比氨水强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH | |
| C. | 若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 | |
| D. | 将NaOH溶液和氨水各稀释一倍,两者的c(OH-)均减小到原来的一半 |
17.下列不能用于鉴别SO2和CH4两种无色气体的试剂是( )
| A. | 氢氧化钠溶液 | B. | 品红溶液 | ||
| C. | 澄清石灰水 | D. | 酸性高锰酸钾溶液 |
15.化学与生产、生活密切相关.下列有关说法,正确的是( )
| A. | 高炉炼铁时,增加炉高,可以改变尾气中一氧化碳的含量 | |
| B. | 厨房中燃气泄漏,立即打开抽油烟机排气 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 食盐中加碘单质可以减少碘缺乏症 |
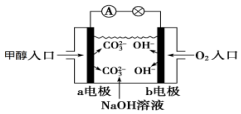 如图是甲醇燃料电池原理示意图,请回答下列问题:
如图是甲醇燃料电池原理示意图,请回答下列问题: