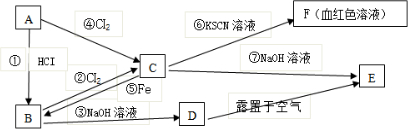
题目内容
11.NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 2 g氢气所含原子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 2.7g金属铝和足量盐酸反应,失去的电子数目为0.2NA |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
B.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算,1mol碳酸钠含有2mol钠离子;
C.常温常压下Vm≠22.4L/mol;
D.铝与盐酸反应生成氯化铝,1mol铝生成1mol铝离子失去3mol电子.
解答 解:A.2 g氢气所含原子数为$\frac{2g/mol}{1g/mol}$×NA=2NA,故A错误;
B.常温常压下,1.06gNa2CO3物质的量为:$\frac{1.06g}{106g/mol}$=0.01mol,含有钠离子物质的量为0.02mol,个数为0.02NA,故B正确;
C.常温常压下Vm≠22.4L/mol,Vm未知,无法计算氮气物质的量和所含的原子个数,故C错误;
D.2.7g金属铝物质的量为:$\frac{2.7g}{27g/mol}$=0.1mol,与足量盐酸反应生成0.1mol铝离子,失去电子数目为0.3NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积使用条件是解题关键,题目难度不大.

练习册系列答案
相关题目
1.使10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的量的是( )
| A. | KNO3 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(Fe3+)=0.1mol/L的溶液中:K+、Mg2+、SCN-、SO42- | |
| B. | c(H+)=1mol/L的溶液中:Cu2+、Na+、ClO-、S2- | |
| C. | 能使酚酞变红的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | pH=2的溶液中:Na+、Ag+、I-、NO3- |
19.下列叙述中不正确的是( )
| A. |  可用装置鉴别碳酸钠和碳酸氢钠 | |
| B. | 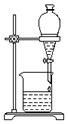 可用装置分离汽油和水的混合物 | |
| C. | 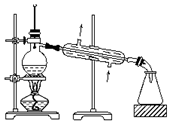 可用装置从海水中蒸馏得到淡水 | |
| D. | 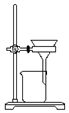 可用装置把胶体粒子从分散系中分离出来 |
16.某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的是( )
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将镁蒸气在氮气中冷却得到镁粉 |
3. 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔:
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$ 乙炔$\stackrel{③}{→}$聚乙炔
写出反应②③的化学方程式②CaC2+2H2O=Ca(OH)2+C2H2↑、③nC2H2$\stackrel{一定条件}{→}$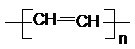 .
.
(2)试管B收集用的产品中,有能使酸性高锰酸钾溶液褪色的物质,其一氯化物有4种.并写出该物质与硝酸反应的化学方程式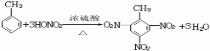 .
.
(3)锥形瓶C中观察到的现象棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8
(4)某有机物常温下为液体,与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,该有机物的结构简式可能为CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2.
 某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:
某废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图,加热聚丙烯废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$ 乙炔$\stackrel{③}{→}$聚乙炔
写出反应②③的化学方程式②CaC2+2H2O=Ca(OH)2+C2H2↑、③nC2H2$\stackrel{一定条件}{→}$
(2)试管B收集用的产品中,有能使酸性高锰酸钾溶液褪色的物质,其一氯化物有4种.并写出该物质与硝酸反应的化学方程式
 .
.(3)锥形瓶C中观察到的现象棕黄色溶液变无色或褪色.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为4.8
(4)某有机物常温下为液体,与乙烯互为同系物,相对分子质量在86以内,且与HBr加成产物只有一种结构,该有机物的结构简式可能为CH3CH2CH=CHCH2CH3、(CH3)2C=C(CH3)2.
20.下列说法中正确的是( )
| A. | 油脂在碱性条件下水解可生成甘油和高级脂肪酸 | |
| B. | 葡萄糖注射液不能产生丁达尔效应,不属于胶体 | |
| C. | 医用酒精的体积分数通常是90% | |
| D. | 对“地沟油”进行分馏可得到汽油 |