题目内容
19.下列叙述中不正确的是( )| A. |  可用装置鉴别碳酸钠和碳酸氢钠 | |
| B. | 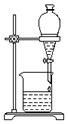 可用装置分离汽油和水的混合物 | |
| C. | 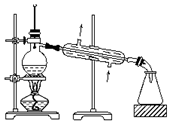 可用装置从海水中蒸馏得到淡水 | |
| D. | 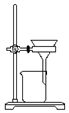 可用装置把胶体粒子从分散系中分离出来 |
分析 A.碳酸氢钠加入分解生成的二氧化碳,而碳酸氢钠不分解;
B.汽油不溶于水,混合液分层;
C.可以通过蒸馏的方法将海水转化成淡水,温度计水银球及冷凝管的通水方向都合理;
D.胶体粒子能够通过滤纸,无法通过过滤分离胶粒.
解答 解:A.碳酸氢钠加热分解产生的二氧化碳气体能够使澄清石灰水变浑浊,而碳酸钠加热不分解,可用图示装置鉴别碳酸钠和碳酸氢钠,故A正确;
B.汽油与水混合分层,可用图示装置分离汽油和水的混合物,故B正确;
C.可用蒸馏装置从海水中蒸馏得到淡水,图示装置合理,故C正确;
D.胶粒能够通过滤纸,无法用装置把胶体粒子从分散系中分离出来,应该用半透膜,故D错误;
故选D.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及碳酸钠与碳酸氢钠的性质、胶体性质、分液、蒸馏等知识,明确常见化学实验基本操作方法为解答关键,注意掌握常见物质组成、结构与性质,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓硫酸稀释
④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧
⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
①液态水变成水蒸气 ②酸碱中和反应 ③浓硫酸稀释
④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧
⑥NH4Cl晶体与Ba(OH)2•8H2O混合搅拌.
| A. | ①⑤⑥ | B. | ②③④⑤ | C. | ②③④ | D. | ①③⑤ |
10.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18g H2O中含有的质子数为10NA | |
| B. | 25℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA | |
| C. | 2.24LCO2中含有的原子数为0.3 NA | |
| D. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
7.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的体积扩大两倍,测得A的浓度变为0.35mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | 平衡正向移动 | C. | B的浓度增大 | D. | A的转化率降低 |
4.以乙烯为原料生产环氧乙烷,经典的方法是氯代乙醇法,包括以下两步反应:
①CH2=CH2+Cl2+H2O→CICH2CH2OH+HCI
②ClCH2CH2OH+HCl+Ca(OH)2→ +CaCl2+2H2O
+CaCl2+2H2O
总的反应可表示为:
CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O
+CaCl2+H2O
现代石油化式采用银作催化剂,可一步完成例:
2CH2=CH2+O2 $\stackrel{Ag}{→}$
经典的生产工艺的原子利用率是( )
①CH2=CH2+Cl2+H2O→CICH2CH2OH+HCI
②ClCH2CH2OH+HCl+Ca(OH)2→
 +CaCl2+2H2O
+CaCl2+2H2O总的反应可表示为:
CH2=CH2+Cl2+Ca(OH)2→
 +CaCl2+H2O
+CaCl2+H2O现代石油化式采用银作催化剂,可一步完成例:
2CH2=CH2+O2 $\stackrel{Ag}{→}$

经典的生产工艺的原子利用率是( )
| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
11.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 2 g氢气所含原子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 2.7g金属铝和足量盐酸反应,失去的电子数目为0.2NA |
8.关于阿斯匹林的作用叙述中不正确的是( )
| A. | 杀菌消炎 | B. | 解热镇痛 | C. | 防止心脏病发作 | D. | 提高免疫力 |



