题目内容
9.氢气最有可能成为21世纪的主要能源,但氢气需要由其他物质来制备.制氢的方法之一是以煤的转化为基础,其基本原理是用碳、水在气化炉中发生如下反应:C(s)+H2O(g)?CO(g)+H2(g)△H1=+131.3kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H2
(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=-41kJ/mol.
产物中的H2与平衡体系中的C、CO2继续发生如下反应,可生成甲烷.
C(s)+2H2(g)?CH4(g)△H3=-74.8kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H4,则△H4=-165.1kJ/mol.
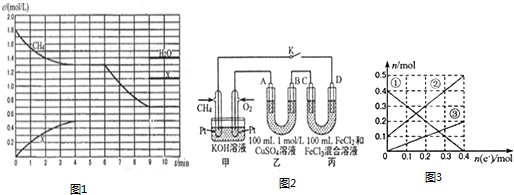
(2)在1L容积固定的密闭容器中投入1.8molCH4和3.6molH2O(g),若只发生反应:CH4(g)+2H2O(g)?CO2(g)+4H2(g),测得CH4、H2O(g)及某一生成物X的物质的量浓度(c)随反应时间(t)的变化如图1所示,第9min前H2O(g)的物质的理浓度及第4min~9min之间X所代表生成物的物质的量浓度变化曲线未标出,条件有变化时只考虑一个条件.
①0~4min内,H2的平均反应速率v(H2)=0.5mol•L-1•min-1.
②以上反应在第5min时的平衡常数K=0.91.(计算结果保留两位小数)
③第6min时改变的条件是升高温度.
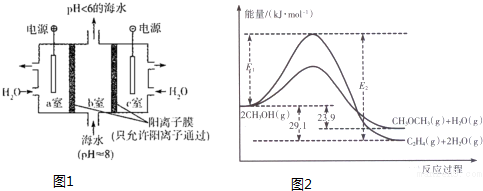
(3)用甲烷做燃料电池电解CuSO4溶液、FeCO3和FeCl2混合液的示意图如图2所示,其中A、B、D均为石墨电极、C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同(相同条件下).
①甲中通入O2的一极为正极(填“正”或“负”),通入甲烷一极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O.
②乙中A极析出的气体在标准状况下的体积为2.24L.
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3所示,则图中③线表示的是Cu2+(填离子符号)的变化;原溶液中c(Fe2+)=1mol/L.
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此计算反应热,依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
结合温度对反应速率的影响来解答.
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,根据电子转移守恒计算生成气体的物质的量,进而计算氧气的体积;
③C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
解答 解:(1)已知1molH-H、O-H、C=O、C≡O化学键断裂时分别需要吸收436kJ、458.5kJ、799kJ、1076kJ的能量,则△H2=1076kJ/mol+2×458.5kJ/mol-2×799kJ/mol-436kJ/mol=-41kJ/mol;
由①C(s)+H2O(g)?CO(g)+H2(g)△H1=+131.3kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=-41kJ/mol
③C(s)+2H2(g)?CH4(g)△H3=-74.8kJ•mol-1
结合盖斯定律③-①-②得到CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H4,则△H4=-165.1kJ/mol,
故答案为:-41kJ/mol;-165.1kJ/mol;
(2)根据图象0-4min甲烷减少0.5mol/L,X增加0.5mol/L,则X为二氧化碳,4-6min为平衡状态,
CH4(g)+2H2O(g)═CO2(g)+4H2(g)
开始 1.8 3.6 0 0
转化 0.5 1 0.5 2
平衡 1.3 2.6 0.5 2
①0~4min内,H2的平均反应速率υ(H2)=$\frac{2mol/L}{4min}$=0.5mol•L-1•min-1,
故答案为:0.5;
②反应在5min时的平衡常数K=$\frac{0.5×{2}^{4}}{1.3×2.{6}^{2}}$=0.91,
故答案为:0.91;
③根据图象第6 min~9 min时的反应速率比0~4 min时的大,且平衡向正反应方向移动,说明第6 min改变的条件为升高温度或增加水蒸气的量,再根据第9 min平衡时甲烷浓度为0.7 mol/L,水蒸气浓度为1.4 mol/L,说明甲烷消耗1.1 mol,水蒸气消耗2.2 mol,所以不可能为增加水蒸气的量,因此改变的条件只可能为升高温度,
故答案为:升高温度;
(3)①甲中通入O2的一极发生还原反应为正极;负极发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:正;CH4-8e-+10OH-=CO32-+7H2O;
②乙为电解池,A为阳极、B为阴极,A电极生成气体为氧气,B电极先析出Cu,而后生成气体为氢气,析出Cu的物质的量为0.1L×1mol/L=0.1mol,设氧气、氢气的物质的量均为n mol,根据电子转移守恒:4n=2n+0.1×2,解得n=0.1,故A极析出的氧气在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
③根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据②计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,原溶液中有Fe2+ 0.1mol,所以原溶液中c(Fe2+)=$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:Cu2+;1mol/L.
点评 本题综合性较大,题目涉及燃料电池、电解原理的应用、离子浓度大小比较、电极反应式书写以及据电极反应式的计算,盖斯定律计算和热化学方程式书写方法,题目难度中等,注意把握原电池和电解质中电极方程式的书写以及电子守恒在计算中的应用.

| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 铁粉 |
(1)溶于海水的CO2有4种存在形式.其中HCO3-占95%,除上述两种形式外,碳的存在形式还有H2CO3、CO32- (填微粒符号);利用图1装置进行的实验中,a室的电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑.
(2)下列为合成甲醇的有关化学方程式
①2H2(g)+CO(g)?CH3OH(g)
②H2(g)+CO2(g)?H2O(g)+CO(g)
③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)
某温度下,上述三个反应的平衡常数数值分别为2.5,2.0和K3,则K3值为5.0.
(3)一定条件下,甲醇可同时发生:
A.2CH3OH(g)═CH3OCH3+H2O(g)
B.2CH3OH(g)═C2H4(g)+2H2O(g).
上述反应过程中能量变化如图2所示:
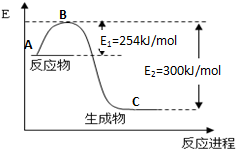
①写出反应速率较大的序号并说明原因A;该反应的活化能较小,在相同条件下反应速率较大.
②若在容器中加入催化剂,则E2-E1将不变〔填“变大”、“不变”或“变小”〕.
(4)一定温度时,容积相同的甲、乙、丙三个恒容密闭容器中,按不同方式投入反应物,发生反应2H2(g)+CO(g)?CH3OH(g)△H=-90kJ/mol,测得达平衡时的有关数据如下表:
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2molH2(g) 1molCO(g) | 1mol CH3OH(g) | 2mol CH3OH(g) | |
| 平衡 | c(CH3OH)/mol/•L-1 | c1 | c2 | c3 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 | |
②在温度不变、恒容条件下,该反应的平衡常数数值Kp=4.80×10-2,若甲容器中反应达平衡状态时,p(CH3OH)=24.0kPa,则平衡时,混合气体中CH3OH的物质的量分数为61.5% (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数).
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
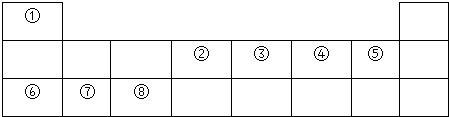
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O;
(4)按要求写出下列两种物质的电子式:②的氢化物
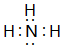 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为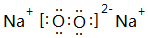 .
.  到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.