题目内容
19. 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
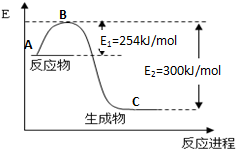
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
分析 (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式,16g的甲烷(CH4)即1mol完全燃烧生成CO2和液态水时放出akJ的热量,标注物质聚集状态和对应焓变写出;
(2)①根据反应物总能量大于生成物总能量判断该反应为放热反应;再据焓变等于反应物活化能减去生成物活化能求算焓变,再书写热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
③根据N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol及消耗的氮气计算放出的热量;
(3)已知:Ⅰ.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
Ⅱ.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),据此计算.
解答 解:(1)16g的甲烷(CH4)即1mol完全燃烧生成CO2和液态水时放出akJ的热量,标注物质聚集状态和对应焓变写出热化学方程式为:CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol;故答案为:CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol;
(2)①有图可知,反应物总能量大于生成物总能量,则该反应为放热反应;又焓变等于反应物活化能减去生成物活化能求算焓变,所以N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的△H=254KJ/mol-300KJ/mol=-46KJ/mol,所以生成2mol NH3的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-46KJ/mol×2=-92KJ/mol,故答案为:放热;N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则943+3×435-6x=-92,x=390,故答案为:390;
③因为放入1mol N2和3mol H2,10分钟后N2的转化率为15%,所以消耗氮气为0.15mol,又N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol,则放出的热量为0.15mol×92KJ/mol=13.8KJ,故答案为:13.8;
(3)已知:Ⅰ.CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1
Ⅱ.CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJ•mol-1
根据盖斯定律,Ⅰ×2-Ⅱ可得:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),△H3=2△H1-△H2=2×(-53.7kJ•mol-1)-23.4kJ•mol-1=-130.8kJ•mol-1,
故答案为:-130.8.
点评 本题考查了化学反应能量变化分析判断,热化学方程式书写方法和盖斯定律的计算应用,掌握基础是关键,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
(2)500℃,固定容器的密闭容器中,放入混合物,其始浓度为c(A)=0.25mol/L,c(B)=0.60mol/L,c(C)=0.30mol/L,则反应开始时,B的消耗速率比生成速率不能确定 (填“大”、“小”或“不能确定”).
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 稀硫酸除铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫酸和Ba(OH)2反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
| A. | NH4Cl的电子式: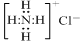 | |
| B. | 2-硝基甲苯的结构简式: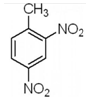 | |
| C. | 硫原子结构示意图: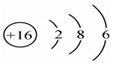 | |
| D. | 质子数为94、中子数为144的钚原子:${\;}_{94}^{144}$Pu |