题目内容
8.下列事实中,不能用勒夏特列原理解释的是( )| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积,压强增大,平衡不移动,但,溶液浓度变大,颜色变浅,故A选;
B.合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施,有利于平衡向正反应方向移动,故B不选;
C.该反应是可逆反应,让K成蒸汽从反应混合物中分离出来,减小生成物的浓度能上平衡正向移动,能用勒夏特列原理解释,故C不选;
D.开启啤酒瓶后,瓶中马上泛起大量泡沫,是压强对其影响导致的,属于可逆反应,能用勒夏特列原理解释,故D不选;
故选A.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
19.下列有关物质分类或归类正确的一组是( )
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
①酸性氧化物:SO2、NO、CO2、SiO2
②蛋白质、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、硫酸钡、HClO均为电解质
④碘酒、牛奶、豆浆、漂粉精均为胶体
⑤液氨、液氯、干冰、碘化银均为化合物.
| A. | ①和③ | B. | ③和④ | C. | ②和③ | D. | ②和⑤ |
16.下列离子方程式的书写正确的是( )
| A. | 电解氯化镁溶液的阴极电极反应式:Mg2++2e-═Mg | |
| B. | 惰性电极电解饱和食盐水:2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | 醋酸与乙醇混合、浓硫酸催化加热:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | 硫酸铝和小苏打溶液混合:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
3.自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是( )
| A. | 所有的油脂都不能使溴水褪色 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 淀粉可以发生水解反应 | |
| D. | 食用纤维素、淀粉、蛋白质、植物油都是高分子化合物 |
13.下列说法正确的是( )
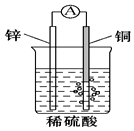

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| C. | 右图原电池中,电池工作时,SO42-移向电池的正极 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
20.下列事实中,与电化学腐蚀无关的是( )
| A. | 镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| B. | 在空气中,光亮的银器表面逐渐变暗 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.5 mol•L-1的Fe2(SO4)3 溶液中Fe3+的数目为NA | |
| B. | 室温下,pH=13的NaOH溶液中,OH-离子数目为0.1NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g |
17.X、Y、Z、W是原子序数依次增大的四种短周期元素.其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物与其最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3:4.下列说法中正确的是( )
| A. | 原子半径:W>Z>Y>X | B. | 氢化物稳定性:Y>Z | ||
| C. | WY3中只有离子键没有共价键 | D. | YX3可用于检验Cl2泄漏 |