题目内容
2.在一定温度下,某体积不变的密闭容器中,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )| A. | 混合气体的密度不变 | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内生成2n mol的AB,同时生成n mol的B2 |
分析 当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A.该反应前后都是气体,气体的总质量始终不变,容器容积不变,则气体密度始终不变,密度不能作为判断平衡状态的依据,故A错误;
B.该反应前后气体体积不变,则压强始终不变,不能根据压强判断平衡状态,故B错误;
C.容器中各组分的体积分数不随时间变化,说明正逆反应速率相等,达到了平衡状态,故C正确;
D.单位时间内生成2n mol的AB,同时生成n mol的B2,表示的是正逆反应速率,且满足化学计量数关系,说明达到平衡状态,故D正确;
故选CD.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的概念及特征为解答关键,A、B为易错点,注意反应过程中气体密度、压强为定量.

练习册系列答案
相关题目
12.下列各物质相互反应时,水即不作氧化剂又不作还原剂,但属于氧化还原反应的是( )
①F2与H2O; ②Na2O2和H2O;③NO2与H2O;④Cl2+H2O;⑤K与FeCl3 溶液;⑥P2O5与H2O.
①F2与H2O; ②Na2O2和H2O;③NO2与H2O;④Cl2+H2O;⑤K与FeCl3 溶液;⑥P2O5与H2O.
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ④⑤⑥ |
13. W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A. | 对应简单离子半径:Z>X>W | |
| B. | 对应气态氢化物的稳定性Y>Z | |
| C. | 化合物XZW既含离子键,又含共价键 | |
| D. | Y的氧化物既能与Z的氢化物溶液反应,又能与X的最高价氧化物对应水化物的溶液反应 |
7.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是同系物 | D. |  和 和  是同一种物质 是同一种物质 |
14.金属可以发生多种反应.其中正确的是( )
| A. | 铜与稀硫酸反应生成氢气 | |
| B. | 铁与水反应生成氢氧化铁和氢气 | |
| C. | 钠投入CuSO4溶液中,可以置换出铜 | |
| D. | 某溶液与铝反应产生氢气,该溶液不一定是酸性溶液 |
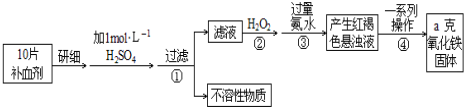
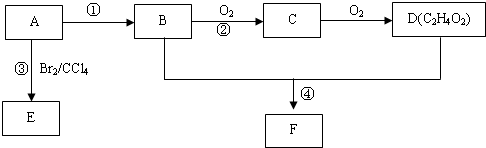
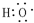 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.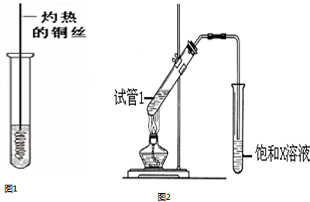
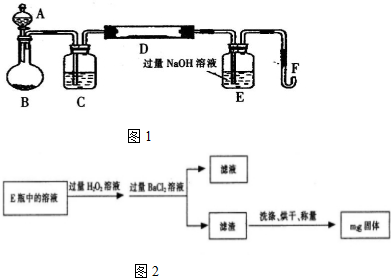
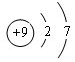 .
.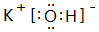 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.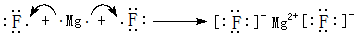 .
.