题目内容
2.下列关于化学键的说法正确的是( )| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 金属和非金属化合时一定形成离子键 | |
| D. | 含有共价键的化合物都是共价化合物 |
分析 化学键是相邻的原子之间强烈的相互作用,化学键有离子键、共价键和金属键,注意并不是所有物质都含有化学键.
解答 解:A.构成单质分子的微粒不一定含有共价键,如稀有气体,故A错误;
B.由非金属元素组成的化合物不一定是共价化合物,如铵盐,故B正确;
C.氯化铝是金属和非金属化合形成共价键,故C错误;
D.离子化合物一定含有离子键,也可能含有共价键,如过氧化钠,故D错误;
故选B.
点评 本题考查了化学键和物质的关系,难度不大,易错选项是A,注意稀有气体是单原子分子,只存在分子间作用力,不含化学键,为易错点.

练习册系列答案
相关题目
12.几种短周期元素的原子半径及某些化合价见表
分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E从HE的溶液中置换出来 | |
| B. | 气态氢化物的稳定性:D>A>B | |
| C. | 离子半径由大到小的顺序是A>J>H | |
| D. | 最高价氧化物的水化物的碱性:H>I>J |
13.短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X 元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的简单氢化物稳定性比Z的简单氢化物稳定性低 | |
| D. | Y与W形成的化合物YW2的熔点高、硬度大 |
17.下列有关乙烯的说法,其中错误的是( )
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷( )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
7.A、B两种元素,A的原子序数为a,A和B所在周期所含的元素种类分别是m和n,如果A和B同在ⅣA族,当B在A的下一周期时,B的原子序数为( )
| A. | a-n | B. | a+m | C. | a-m | D. | a+n |
14.A,B均为短周期元素,已知A元素原子的最外层电子数为a,次外层电子数为b; B元素原了的M 层电子数为(a-b),L层电子数为(a+b),则A、B所形成的化合物的性质可能有( )
| A. | 能与水反应 | B. | 能与NaOH溶液反应 | ||
| C. | 能与稀硫酸反应 | D. | 在空气中能燃烧 |
12.下列叙述中一定能说明A的金属性比B强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | 常温时,A能从盐酸中置换出氢气,而B不能反应 | |
| C. | B不能从溶液中置换出A | |
| D. | 1 mol A失去的电子比1 mol B失去的电子多 |
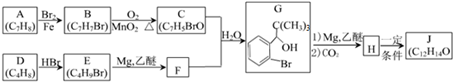
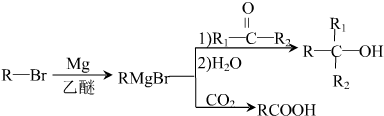
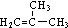 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.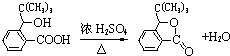 (写明反应条件).
(写明反应条件).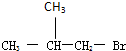 .
.
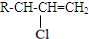
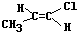 .
.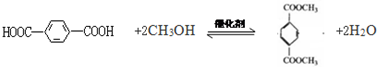 .
.