题目内容
14.A,B均为短周期元素,已知A元素原子的最外层电子数为a,次外层电子数为b; B元素原了的M 层电子数为(a-b),L层电子数为(a+b),则A、B所形成的化合物的性质可能有( )| A. | 能与水反应 | B. | 能与NaOH溶液反应 | ||
| C. | 能与稀硫酸反应 | D. | 在空气中能燃烧 |
分析 元素A和B的原子序数都小于18.B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为O元素,B为的M层电子数为6-2=4,故B为Si元素,A、B两元素所形成的化合物为SiO2,结合物质的性质解答.
解答 解:元素A和B的原子序数都小于18.B元素原子的M层电子数为(a-b),L层电子数为(a+b),则a+b=8,A元素原子最外层电子数为a,次外层电子数为b,则A元素的次外层为K层,即b=2,有2个电子层,所以a=8-2=6,故A为O元素,B为的M层电子数为6-2=4,故B为Si元素,A、B两元素所形成的化合物为SiO2,
A.SiO2不溶于水,不与水反应,故A错误;
B.SiO2能与氢氧化钠反应,生成硅酸钠与水,故B正确;
C.SiO2性质稳定,不硫酸反应,能与氢氟酸反应,故C错误;
D.SiO2性质稳定,与氧气不再反应,故D错误.
故选B.
点评 本题以元素推断为载体,考查原子结构与位置关系、核外电子排布规律、元素化合物性质等,为高考常见题型,难度不大,理解核外电子排布规律,推断元素是解题关键.

练习册系列答案
相关题目
4.若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、HCO3-、[Al(OH)4]- | ||
| C. | NO3-、Ca2+、K+、Fe2+ | D. | NO3-、K+、[Al(OH)4]-、OH- |
5.下列每组中各有3对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | |
| D. | 油酸和水,甲苯和水,己烷和水 |
2.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 金属和非金属化合时一定形成离子键 | |
| D. | 含有共价键的化合物都是共价化合物 |
9.将有机物完全燃烧,生成CO2和H2O.将12.4g该有机物的完全燃烧产物通过浓H2SO4,浓硫酸增重 10.8g,再通过碱石灰,碱石灰又增重了17.6g.下列说法正确的是( )
| A. | 该有机物的最简式为 CH3O | B. | 该有机物的分子式可能为 CH3O | ||
| C. | 该有机物的分子式可能为 C2H6O | D. | 该有机物1H核磁共振谱中有两个峰 |
19.下列叙述正确的是( )
| A. | NH3、CO、CO2都是极性分子 | |
| B. | 10Be、9Be、8Be是摩尔质量不同的三种同素异形体 | |
| C. | HF、HCl、HBr、HI的稳定性依次增强 | |
| D. | HF、HCl、HBr、HI的酸性依次增强 |
6.下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的是( )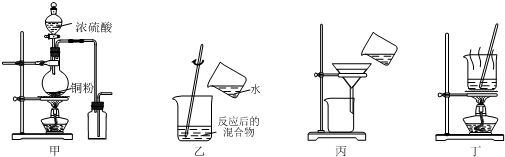

| A. | 用图甲装置制取并收集二氧化硫 | |
| B. | 用图乙装置向反应后的混合物中加水稀释 | |
| C. | 用图丙装置过滤出稀释后混合物中的不溶物 | |
| D. | 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶 |
3.现行的长式周期表,由左到右为18列,碱金属族为第1列,稀有气体为第18列.按这个规定,下列说法中错误的是( )
| A. | 过渡元素包括七个副族和第Ⅷ族的元素 | |
| B. | 第3列中元素种类最多 | |
| C. | 第17列的第一种元素对应最高价氧化物的水化物是最强的含氧酸 | |
| D. | 第15列元素的氢化物组成通式可用RH3表示 |
4.X、Y、Z三种元素的原子具有相同的电子层数,它们的最高价氧化物的水化物酸性由强至弱的顺序是H3XO4<H2YO4<HZO4,则下列说法正确的是( )
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由强至弱的顺序是X>Y>Z | |
| C. | 原子半径大小顺序是X>Y>Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |