题目内容
14.对于强碱性条件的甲醇燃料电池,下列说法正确的是( )| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
分析 强碱性条件的甲醇燃料电池,负极上甲醇失去电子生成碳酸根离子,正极上氧气得到电子生成氢氧根离子,阴离子向负极移动,以此来解答.
解答 解:A.负极反应式:CH3OH-8e-+8OH-=CO32-+6H2O,故A错误;
B.电池工作时,CH3OH失去电子,发生氧化反应,被氧化,故B错误;
C.电池工作时,溶液中的阴离子向负极移动,故C正确;
D.电池工作一段时间后,消耗碱,氢氧根离子浓度减小,溶液的pH减小,故D错误;
故选C.
点评 本题考查原电池,为高频考点,把握电极判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意电解对电极反应的影响,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列有关物质的保存方法不正确的是( )
| A. | 浓氨水、浓硝酸应保存在棕色试剂瓶中,并置于阴凉处 | |
| B. | 液溴易挥发,应保存在棕色试剂瓶中,并加水封 | |
| C. | 在储存铵态化肥时,应密封包装并放在阴凉通风处 | |
| D. | 碘易升华,应保存在棕色细口瓶中,并置于阴凉处 |
5.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | H2SO4 | C. | SO2 | D. | NaCl |
9.常温下,氨水与硫酸铵的混合液pH=7时,c(SO42-)与 c(NH4+)之比为( )
| A. | 等于1:2 | B. | 小于1:2 | C. | 等于2:1 | D. | 大于2:1 |
19.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130KJ/mol
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
6.下列各组离子能大量共存的是( )
| A. | 无色溶液中:Na+、Cu2+、NO3-、Cl- | |
| B. | 在pH=4的溶液中:Na+、K+、OH-、Cl- | |
| C. | 在含Ba2+的溶液中:H+、Na+、Cl-、SO42- | |
| D. | 与Fe反应产生气体的溶液:Na+、K+、Cl-、SO42- |
3.下列电池工作时,负极上有H2参与反应的是( )
| A. |  氢燃料电池 | B. |  锌锰碱性电池 | C. |  铅蓄电池 | D. |  银锌纽扣电池 |
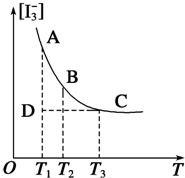 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).