题目内容
9.下列方程式中,书写正确的是( )| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
分析 A、多元弱酸的电离分步进行;
B、碳酸是弱酸,故HCO3-不能完全电离;
C、盐的单水解程度不大,应用可逆号;
D、书写溶解平衡表达式时,难溶物和溶解出的离子要标示状态,且用可逆号.
解答 解:A、多元弱酸的电离分步进行,故H2S的电离方程式应为:H2S?HS-+H+,HS-?S2-+H+,故A错误;
B、碳酸是弱酸,故HCO3-不能完全电离,故NaHCO3的电离方程式为:NaHCO3═Na++HCO3-,故B错误;
C、盐的单水解程度不大,应用可逆号,故水解方程式为:NH4++H2O?NH3•H2O+H+,故C错误;
D、书写溶解平衡表达式时,难溶物和溶解出的离子要标示状态,且用可逆号,故BaSO4的溶解平衡的表达式为:BaSO4(s)?Ba2+(aq)+SO42-(aq),故D正确.
故选D.
点评 本题考查了电离方程式、水解方程式和溶解平衡表达式的书写,应注意区分难溶电解质的电离方程式和溶解平衡表达式的书写的区别.

练习册系列答案
相关题目
19.描述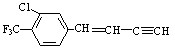 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )
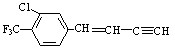 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
20.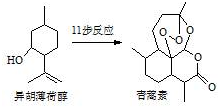 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年我国药物化学家屠吆吆因发明抗疟疾新药青蒿素和双氢青蒿素被授予诺贝尔生理学或医学奖.以异胡薄荷醇为起始原料是人工合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇遇FeCl3溶液显紫色 | |
| B. | 异胡薄荷醇可发生消去反应、加成反应 | |
| C. | 青蒿素分子中含有5个手性碳原子 | |
| D. | 青蒿素在热的酸、碱溶液中均可稳定存在 |
4.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |
14.现某溶液中可能含有下列6种离子中的某几种:Na+、NH4+、K+、Cl-、SO42-、CO32-.为确认溶液组成进行如下实验:
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
(1)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)取200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量盐酸,有2.33g沉淀不溶;
(3)向(2)所得滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).
由此可以得出关于原溶液组成的正确结论是( )
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
1.下列说法中,正确的是( )
| A. | 有机物 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物 的名称为2,3,6三甲基5乙基庚烷 的名称为2,3,6三甲基5乙基庚烷 | |
| C. |  既属于醇类又属于羧酸 既属于醇类又属于羧酸 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
18.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4 LH2O含有NA个水分子 | |
| B. | 标准状况下,22.L空气含有NA个单质分子 | |
| C. | 常温常压下,11.2 L氯气所含的原子数目为NA | |
| D. | 标准状况下,1.12 L O2 和1.12 L CO2均含有0.1NA氧原子 |
19. 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
 如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )
如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )| A. | 钠悬浮在煤油层中 | |
| B. | 钠静止在两液面之间 | |
| C. | 钠沉入水底下 | |
| D. | 钠熔化成闪亮的小球,在两液体界面附近上下跳动 |
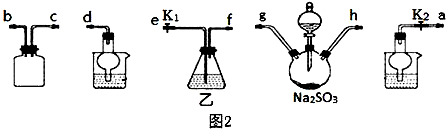
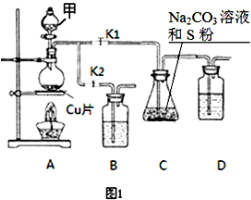 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.