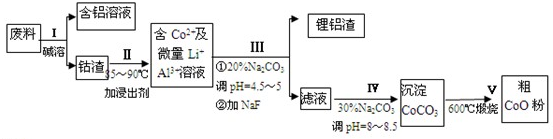
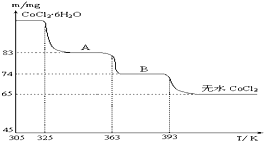
题目内容
4.下列各组离子在指定溶液中一定能大量共存的是( )| A. | c(H+ )=1.0×10-13mol/L溶液:C6H5O-、K+、SO42-、Br- | |
| B. | 能使紫色石蕊变红的溶液中:NO3-、I-、Ba2+、AlO2- | |
| C. | pH=2的溶液中:Na+、S2-、HCO3-、Ca2+ | |
| D. | 能与金属铝反应放出氢气的溶液:K+ NO3- SO42- NH4+ |
分析 A.c(H+ )=1.0×10-13mol/L溶液,显碱性;
B.能使紫色石蕊变红的溶液,显酸性;
C.pH=2的溶液,显酸性,不能存在弱酸根离子;
D.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:A.c(H+ )=1.0×10-13mol/L溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.能使紫色石蕊变红的溶液,显酸性,NO3-、I-、H+发生氧化还原反应,且酸性溶液中不能大量存在AlO2-,故B错误;
C.pH=2的溶液,显酸性,S2-、HCO3-不能大量存在,故C错误;
D.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液,酸溶液中NO3-、Al、H+发生氧化还原反应不生成氢气,碱溶液中不能大量存在NH4+,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
15.下列物质既具有氧化性又有还原性的是( )
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
①SO2 ②CO2 ③Fe2+ ④HCl ⑤H2O2.
| A. | ①②③ | B. | ①③ | C. | ①③⑤ | D. | ①③④⑤ |
9.下列方程式中,书写正确的是( )
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NH4++H2O═NH3•H2O+H+ | D. | BaSO4(s)?Ba2+(aq)+SO42-(aq) |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.24 L CO2中含有原子数为0.3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-为0.1NA | |
| C. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA | |
| D. | 1L0.1molL-1的氨水中有NA个NH4+ |
14.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
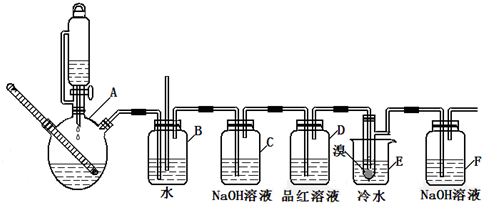
有关数据如表:
请按要求回答下列问题:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.

有关数据如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)下列有关A中反应说法错误的是AD(填编号)
A.将乙醇缓慢加入浓硫酸中配制混合酸
B.温度在140℃时,其主要反应为取代反应
C.浓硫酸的作用是脱水和催化
D.加入碎瓷片的作用是加快反应速度
(3)装置D中品红溶液的作用是验证二氧化硫是否被除尽;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升.
(4)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发,但又不能用冰水,其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(5)装置F中的化学反应方程式为:Br2+2NaOH=NaBr+NaBrO+H2O.
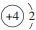 .
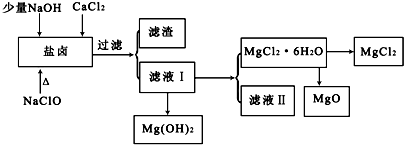
.
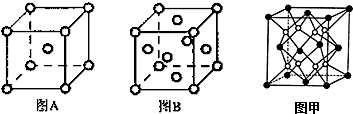 X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示): ,其基态原子有26种运动状态不同的电子;
,其基态原子有26种运动状态不同的电子;