题目内容
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题.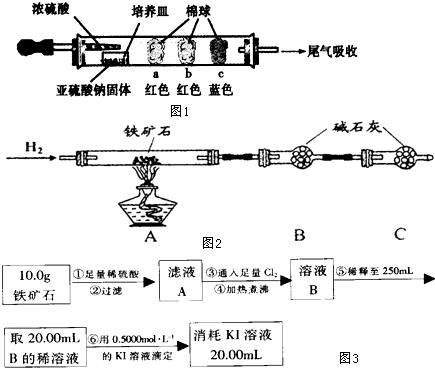
Ⅰ、进行微量实验:如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验.图2是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置.
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为 .
实验二:铁矿石中含铁量的测定(如图3所示)
(1)步骤②和⑤中都要用到的玻璃仪器是 .
(2)下列有关步骤⑥的操作中说法不正确的是 .
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为 .

Ⅰ、进行微量实验:如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 该气体具有 |
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为
实验二:铁矿石中含铁量的测定(如图3所示)
(1)步骤②和⑤中都要用到的玻璃仪器是
(2)下列有关步骤⑥的操作中说法不正确的是
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
考点:性质实验方案的设计,化学方程式的有关计算,探究物质的组成或测量物质的含量
专题:实验设计题
分析:I.a二氧化硫具有漂白性,但其漂白性不稳定,加热时会恢复为原来的颜色;
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应;
II.实验一:铁矿石中含氧量的测定
(1)在氢气还原金属氧化物时,在点燃酒精灯前要验纯;
(2)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
实验二:(1)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(2)根据滴定实验以及滴定过程中的实验误差分析知识判断;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应;
II.实验一:铁矿石中含氧量的测定
(1)在氢气还原金属氧化物时,在点燃酒精灯前要验纯;
(2)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
实验二:(1)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(2)根据滴定实验以及滴定过程中的实验误差分析知识判断;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
解答:
解:I.a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
故答案为:品红溶液;二氧化硫具有漂白性,为暂时性漂白;
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ
故答案为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:含淀粉的碘水;还原性;
II.实验一:
(1)氢气中混有氧气时点燃会产生爆炸,为防止安全事故发生,待C装置出口处H2验纯后,点燃A处酒精灯,故答案为:待C装置出口处H2验纯后;
(2)测的反应后装置B增重1.35g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:
×100%×100%=24%,
故答案为:24%;
实验二:(1)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,若稀释到250mL时采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,则两个过程都需要的玻璃仪器有:烧杯、玻璃棒;
(2)a.滴定管用蒸馏水洗涤后再用待装液润洗,否则会导致测量结果偏大,故正确;
b.锥形瓶不需要用待测液润洗,如果润洗,会导致测量结果偏大,故错误;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故错误;
故选bc;
由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
×100%=70%,
铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
:
=5:6,铁的氧化物的化学式为:Fe5O6,
故答案为:Fe5O6.
故答案为:品红溶液;二氧化硫具有漂白性,为暂时性漂白;
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ
故答案为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:含淀粉的碘水;还原性;
II.实验一:
(1)氢气中混有氧气时点燃会产生爆炸,为防止安全事故发生,待C装置出口处H2验纯后,点燃A处酒精灯,故答案为:待C装置出口处H2验纯后;
(2)测的反应后装置B增重1.35g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:
| ||
| 5.0g |
故答案为:24%;
实验二:(1)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,若稀释到250mL时采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,则两个过程都需要的玻璃仪器有:烧杯、玻璃棒;
(2)a.滴定管用蒸馏水洗涤后再用待装液润洗,否则会导致测量结果偏大,故正确;
b.锥形瓶不需要用待测液润洗,如果润洗,会导致测量结果偏大,故错误;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故错误;
故选bc;
由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,反应的方程式为2Fe3++2I-=2Fe2++I2,结合方程式可知,c(Fe3+)=c(KI)=0.5mol?L-1,所以铁元素的百分含量为:
| 0.5mol/L×0.25L×56g/mol |
| 10g |
铁的质量分数是70%,氧元素的质量分数是24%,所以100g铁矿石中,铁元素的质量是70g,氧元素质量是24g,铁元素和氧元素的物质的量比为:
| 70 |
| 57 |
| 24 |
| 16 |
故答案为:Fe5O6.
点评:本题考查了探究铁矿石中铁和氧元素的含量、二氧化硫的性质,二氧化硫具有还原性、氧化性、漂白性,根据二氧化硫的这几个性质分析解答;铁矿石中成分及其含量的测定中,根据物质的形成从整体上把握知识点,同时考查学生分析问题、解决问题的能力,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
下列说法中,正确的是( )
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都是烃 |
| B、油脂、淀粉和蛋白质均可发生水解反应 |
| C、乙烯和苯使溴水褪色都是发生加成反应 |
| D、苯环含有碳碳单键和碳碳双键 |
实验是化学研究的基础,下列关于各实验装置的叙述正确的是( )
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、2CN-+H2O+CO2═2HCN+CO32- |
| B、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| C、物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) |
| D、c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
设NA代表阿伏加德罗常数的数值,下列说法中正确 的是( )
| A、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| B、100mL 1mol?L-1 Na[Al(OH)4]溶液中含有0.1NA个[Al(OH)4]- |
| C、标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为NA |
| D、标准状况下,1.12L 1H2和0.2g 2H2均含有0.1NA个质子 |
 在新能领域中,氢能已经普遍被认为是一种最理想的新世纪无污染的绿色能,21世纪将是氢能的世纪.电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
在新能领域中,氢能已经普遍被认为是一种最理想的新世纪无污染的绿色能,21世纪将是氢能的世纪.电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A、电解时,b极是阴极放出H2,发生氧化反应 |
| B、溶液中OH-逐渐向b极移动 |
| C、电解时,a极的电极反应式为:CO(NH2)2+8OH-6e-═CO32-+N2↑+6H2O |
| D、若在b极产生标准状况下224mL H2,则消耗尿素2g |
