题目内容
9.实验室制备下列气体时,所用方法正确的是( )| A. | 制氧气时,用Na2O2或H2O2作反应物选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化和干燥气体 | |
| C. | 制氢气时,用浓硫酸与锌反应比用稀硫酸快 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
分析 A.用Na2O2或H2O2作反应物制备氧气都是利用固体和液体不和加热反应生成,据此选择装置;
B.氯气溶于水和水反应生成盐酸和次氯酸是化学平衡,盐酸和碳酸氢钠能发生反应促进平衡正向进行,不能制备氯气;
C.浓硫酸和锌反应不能生成氢气;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体;
解答 解:A.用Na2O2或H2O2作反应物制备氧气都是利用固体和液体不和加热反应生成,应选择分液漏斗中的液体加入过氧化钠中反应或过氧化氢从分液漏斗中滴入固体二氧化锰催化作用发生反应生成氧气,应选择相同的气体发生装置,故A正确;
B.氯气溶于水和水反应生成盐酸和次氯酸是化学平衡,盐酸和碳酸氢钠能发生反应促进平衡正向进行,生成的氯气通过饱和NaHCO3溶液不能制得氯气,故B错误;
C.浓硫酸和锌反应不能生成氢气,实验室是用稀硫酸和锌反应生成氢气故C错误;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体,不能被吸收,氢氧化钠溶液可以吸收二氧化氮气体,故D错误;
故选A.
点评 本题考查了气体制备、气体除杂、尾气处理等实验基础知识,掌握反应原理和实验基本操作是解题关键,题目难度中等.

练习册系列答案
相关题目
4.下列气体的实验室制法正确的是( )
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
14.T℃时,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线如图所示.则下列说法错误的是( )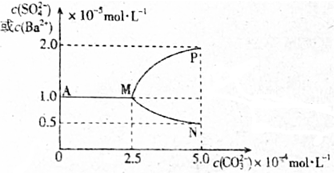

| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
1.下列反应既是氧化还原反应,又是放热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
18.水热法制备纳米颗粒Y的反应是3Fe2++2S2O32-+O2+XOH-═Y+S4O62-+2H2O,下列说法中,正确的是( )
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
19.在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+下列判断正确的是( )
| A. | 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 | |
| B. | 反应的氧化产物只有氧气 | |
| C. | 当反应产生标准状况下2.24 L O2 时,反应转移的电子为0.1mol | |
| D. | 通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液 |