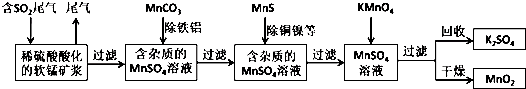
题目内容
3.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的体系( )①是溶液 ②是胶体 ③能产生丁达尔效应 ④静置后会析出黑色沉淀.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
分析 纳米材料”是粒子直径为1~100nm的材料,若将纳米碳均匀地分散到蒸馏水中形成分散系是胶体,依据胶体的特征和性质分析判断问题.
解答 解:纳米材料”是粒子直径为1~100nm的材料,属于胶体分散质微粒直径的大小,若将纳米碳均匀地分散到蒸馏水中形成分散系是胶体,具有丁达尔现象,能透过滤纸,故②③正确;胶体是稳定的,静置不产生沉淀;
故选C.
点评 本题考查了胶体分散系的本质特征,难度不大,胶体性质的应用,分散系的本质区别是分散质微粒直径大小.

练习册系列答案
相关题目
14.T℃时,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线如图所示.则下列说法错误的是( )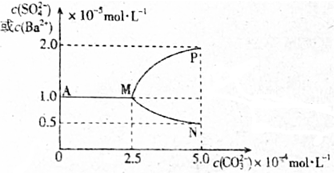

| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
11.下列反应的离子方程式书写正确的是( )
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
18.水热法制备纳米颗粒Y的反应是3Fe2++2S2O32-+O2+XOH-═Y+S4O62-+2H2O,下列说法中,正确的是( )
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
8.以下物质间的每步转化通过一步反应就能实现的是( )
| A. | S→SO3→H2SO4 | B. | Fe→FeCl3→FeCl2 | ||
| C. | Si→H2SiO3→Na2SiO3 | D. | Al2O3→Al(OH)3→NaAlO2 |
15.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法不正确的是( )

| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H<0 | |
| B. | 温度为T1时,向该平衡体系中加入KI固体,平衡不移动 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更低 |
13.将32g Cu与150mL一定浓度的HNO3恰好反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.则下列各项中正确的是( )
| A. | 所用HNO3为浓度为10mol/L | B. | NO的体积为6.72升 | ||
| C. | NO2的体积为3.36升 | D. | 被还原的HNO3为1mol |