题目内容
1.PCl5 的分解反应如下:PCl5(g)?PCl3(g)+Cl2(g)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡时,测得容器内PCl3的浓度为0.150mol/L,(1)计算该温度下的平衡常数.
(2)计算该温度下PCl5的转化率.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
(2)该温度下PCl5的转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:(1)PCl5的起始浓度为$\frac{2mol}{10L}$=0.2mol/L,达到平衡后,测得容器内PCl3的浓度为0.150mol/L,则:
PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.2 0 0
变化(mol/L):0.15 0.15 0.15
平衡(mol/L):0.05 0.15 0.15
所以平衡常数k=$\frac{c(PC{l}_{3})c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{0.15×0.15}{0.05}$=0.45;
答:该温度下该反应的平衡常数为0.45;
(2)该温度下PCl5的转化率=$\frac{0.15mol/L}{0.2mol/L}$×100%=75%,
答:该温度下PCl5的转化率75%;
点评 本题考查化学平衡常数、转化率的计算,书写平衡常数是关键,注意三段式解题法的运用,注意当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,稀溶液中的水分子浓度可不写,对于非水溶液中的反应,溶剂的浓度同样是常数,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s)?Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
| A. | 溶液中I-浓度减小 | B. | 溶度积常数Ksp增大 | ||
| C. | 沉淀溶解平衡向左移动 | D. | 溶液中Pb2+浓度增大 |
12.下列各组物质中,可按溶解、过滤、蒸发结晶的操作顺序分离的是( )
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
9.关于1mol/L K2SO4溶液的下列说法正确的是( )
| A. | 溶液中含有1mol K2SO4 | B. | 1molK2SO4溶于1L水中 | ||
| C. | 溶液中c(K+ )=2mol/L | D. | 1L 溶液中含2molK+,4mol O2- |
16.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
13.已烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是( )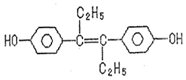

| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
10.有四种物质的量浓度相同且由一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,常温下AX溶液和BY溶液的pH都为7,AY溶液的pH<7,BX的溶液的pH>7.则可能不水解的盐是( )
| A. | AX | B. | BX | C. | AY | D. | BY |
5.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法正确的是( )
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |